cl pauling

Nucléons
& Particules
10-15 m

2
II Isotope
III Radioactivité
IV Grands Types de Radioactivité
VI Energie de cohésion des noyaux - Energie Nucléaire
VII La fission Nucléaire
VIII La Fusion nucléaire
Le Noyau
The nucleus
I Structure du noyau des atomes
IX Importance des isotopes en analyse
N. Bohr
1885-1962
E. Rutherford
1871-1937
M. Planck
1858-1947
J.J. Thomson
1856 -1940
V Cinétique de la radioactivité
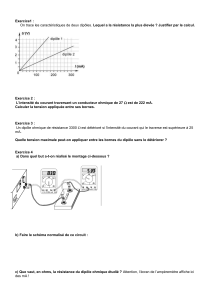
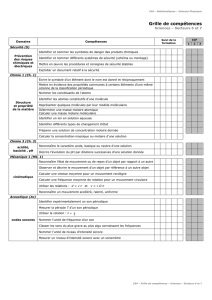
Objectifs : Connaissance de ces concepts
Maitrise et utilisation du vocabulaire
Maitrise et utilisation des relations

Particules
Symbole
Masse
Charge
Taille
Proton
p+
1,6724 10-27 Kg
1,60219 10-19 C
±10-15 m
Neutron
n0
1,6724 10-27Kg
±10-15 m
Electron
e-
9,110 10-31Kg
- 1,60219 10-19C
-


5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%