fiche SL couplage ocean atmosphere

SciencesetLaboratoire‐THEMEL'atmosphèreterrestre
Domaineexploré:L'eauetl'air:couplageatmosphère/géosphère
Problématiquegénérale:
Leréchauffementclimatiquepeut‐ilentraîneruneaugmentationdel'aciditédesocéansetnuireàla
fauneetàlafloremarinesoubienaccroîtrel'augmentationdedioxydedecarbonedansl'atmosphère
(effetpuitsdecarbonedesocéans)etainsis'auto‐amplifier?
Séance«0»:INTRODUCTION
•Présentation:introductionauthèmeàpartirdedocuments:extraitsdelivres,sitesinternet
Suivi:
•D’undébatpourfaireémergerlesdeuxproblématiques.
‐ celledelarelationentreleréchauffementclimatique(doncletauxdeCO2dans
l’atmosphère,sionconsidèrecegazcommeresponsableduréchauffementclimatique)et
l’aciditédel’océan;
‐ celledelarelationentrelatempératuredel’atmosphèreetletauxdedioxydedecarbone,
celui‐cipouvantêtrerelâchéparl’océan,doncmoinssolubledansl’océanquandla
températureaugmente.
Problématique1:
Existe‐t‐ilunlienentreletauxdedioxydedecarboneprésentdansl'atmosphèreetl'aciditéde
l'océan?
QUESTIONNEMENTPREALABLE
Cequestionnementapourobjectifdefaireréfléchirlesélèvessurlamanièredontilestpossiblede
répondreàcetteproblématiqueauniveaudulaboratoire.commentpourrionsrépondreàcette
problématiqueaulaboratoire?
Cetterecherchepeuts’opérereninteractivitéaveclegroupeclasse,enrecueillantdespropositionseten
lesmettantendébat.Uneformulationdequestionsmoinsouvertes(voirci‐dessous)peut
éventuellementêtreproposéesilesélèvesneparviennentpasàfairedepropositions.
Unepremièrerecherchepourraitaussid’effectuerenautonomie,demanièreindividuelleouparpetits
groupes,avecdesaidesapportéesparl’enseignant,sibesoinest:
‐commentsimulercetteinteraction,celien,entrel’atmosphèreetl’eaudel’océanauniveaudu
laboratoire?commentmodéliseruneatmosphèrecontenantdudioxydedecarbone?comment
modéliserunocéan?quellesmesuresfaut‐ileffectuer?.....
Ilconviendraitd’amenerlesélèvesàtrouverlesétapesnécessairesetlesactivitésexpérimentalesà
réaliser:
‐ productiondedioxydedecarbone(ACTIVITE1.1)
‐ créationd’atmosphèresavecdesteneursdifférentesendioxydedecarbone(mesuredutaux
deCO2)(ACTIVITEA.2)
‐ créationd’unesolutiond’océan(salinitéàmesurer)
‐ miseencontactatmosphèresetsolutionocéan(mesuredupHdelasolution,PBducontrôlede
lateneurenCO2)(ACTIVITE1.3)
‐ analysedesrésultatsetréponseàlaproblématique(ACTIVITE1.4)

ACTIVITES
ACTIVITE1.1:
o Objectif:produiredudioxydedecarboneaulaboratoire?
o Activitéexpérimentale:protocoleproposéparunenseignant.
‐Connaissances:identificationdesdifférentesespèceschimiquesmiseenoeuvre.
‐Capacitésetattitudes:
REAréaliserledispositifexpérimentalcorrespondantauprotocole.
REAObserveretdécrirelesphénomènes.
ACTIVITE1.2:
o Objectif:créerdesatmosphèresdedifférentescompositionsendioxydedecarbone
surmontantunvolumed'eau.
o Activitéexpérimentale:protocoleproposéparlesélèvesetmiseenoeuvre.
‐Matériel:capteurdemesuredetauxdeCO2,
‐Connaissances:gaz,compositiond’unmélange,teneurd’ungazdansunmélange,
pressionpartielle
‐Capacitésetattitudes:
ANAproposerunprotocoleetlemettreenœuvre.
REAmaîtriserlesgestestechniques(mesureavecsondeàCO2)
VALvérifierlacohérencedesrésultatsobtenusaveclesrésultatsattendus(évolution
delateneurenCO2avecquantitédegazintroduite)
ACTIVITE1.3:
o Objectif:évaluerl'influencedelapressionpartiellededioxydedecarbonesurl'acidité
delasolutionàtempératureconstante.?
o Activitéexpérimentale:réaliserunesolutionmodélisantun«océan»,mesurerlepH
d'unesolutionetletauxdedioxydecarbonedansunmélangegazeux.
‐Matériel:capteurdemesuredetauxdeCO2,pHmètre.
‐Connaissances:solutionacide,pH.
‐Capacitésetattitudes:
REAmaîtriserlesgestestechniques(mesureavecsondepH)
ANAdéfinirlesconditionsd’utilisationdesinstrumentsdemesures(pHmètre).
ACTIVITE1.4:
o Objectif:présenterladémarchesuivieetunesynthèsedesrésultatsobtenus.
o Activité:constructiond'undocumentdeprésentation(rapports«d’expert»,
diaporama,affiche,exposéoral).
‐Capacitésetattitudes:
COM:communiquerdefaçonécrite
COM:communiquerdefaçonorale

SYNTHESEcollectiveréaliséeàpartirdesproductionsdesélèves,
TRACEECRITE:problématique1,démarcheentreprise,schématisationdesexpériences,
résultatsetconclusions(réponseàlaproblématique).
NB:onpourras’interrogersurl’espèceresponsabledel’aciditédel’océan.Lesélèvesontapprisen
troisièmequel’ionhydrogèneH+estresponsabledel’acidité.Onpourraexpliquerauxélèvesla
dissolutiondudioxydedecarbonedansl’eauetsaréaction(acide‐base)surl’eauquiformedesions
hydrogène.
Problématique2:
Lesocéanssont‐ilsdemoinsbons«puitsdecarbone»quandlatempératureaugmente?
Autrementdit:Lasolubilitédudioxydedecarbonedansl’océandiminue‐t‐elleaveclatempérature?
QUESTIONNEMENTPREALABLE
Toutcommepourlaproblématique1,cequestionnementapourobjectifdefaireréfléchirlesélèvessur
lamanièredontilestpossiblederépondreàcetteproblématiqueauniveaudulaboratoire.
Cettefois‐ci,leprofesseurpeutlaisserlesgroupesd’élèvesenautonomiepourélaborerleurstratégie,
avecbienentendutoujoursdesaidessurlaprocédure,surlescapacitésetlesconnaissancesàmobiliser.
Ils’agiraitd’unréinvestissementdelaméthodologiemiseenoeuvrelorsduquestionnementpréalable
liéàlaproblématique1.
Aidesapportéessousformedequestions:
‐ commentmontrerquel’océanestun«puitsdecarbone»dontl’efficacitédépenddela
température?commentmontrerquec’estun«puitsdecarbone»?Aquellegrandeurphysique
mesurablepeut‐onrelierlacapacitédel’océanàêtreun«puitsdecarbone»?....
Ilpeutêtreproposédeuxsolutions:
‐ unerecherchedocumentaire(ACTIVITE2.1)
‐ uneexpériencemiseenœuvreaulaboratoirepourmontrerqu’uneélévationdela
températuredusystème(atmosphère/océan)conduitàunenrichissementdel’atmosphèreendioxyde
decarbone(ACTIVITE2.2)
ACTIVITES
ACTIVITE2.1:
o Objectif:répondreàlaproblématiqueparunerecherchedocumentaire.
o Activité:Recherchersurinternetetexploiterdesinformationspermettantderépondre
àlaproblématique1.
‐Connaissances:notiondeconcentrationmassique.
‐Capacitésetattitudes:
APP:adopteruneattitudecritiqueetréfléchievis‐à‐visdel’informationdisponible
(tri,exploitationd'information,lecturegraphique,…).
ACTIVITE2.2:
o Objectif:répondreàlaproblématiqueparuneexpériencesimulantunensemble
atmosphère/océanàdestempératuresdifférentes.

o Activitéexpérimentale:créationd'atmosphèresair/dioxydedecarbonedontonfait
varierlatempératureàpressionconstantesurmontantunvolumed'eausaléesimulant
l’océan.
‐Capacitésetattitudes:
ANA:proposeretmettreenœuvreunprotocoleexpérimental,
AUTO:prendredesinitiatives,
REA:réaliserledispositifexpérimental(mesurerunetempératureetuntauxde
dioxydedecarbone)
VAL:extrairelesinformationsdesdonnéesexpérimentalesetlesexploiter
SYNTHESEcollectiveréaliséeàpartirdesrésultatsobtenus.
TRACEECRITE:rappeldelaproblématique2,schématisationdesexpériences,analysedes
résultatsobtenusetconclusions(réponseàcettedeuxièmeproblématique).
SYNTHESEGENERALEduTHEME
ACTIVITE:activitécollectivederetoursurlaproblématiqueetderegardcritiquesurles
résultatsobtenus.
TRACEECRITE:miseenformedelasynthèseconstruiteaveclesélèves.Ilpeutaussiêtre
demandéauxélèvesderédigerunrapport«d’expert»pourlacommissioneuropéenneou
pourleministèredel’écologiesurlaréponseARGUMENTEEàlaproblématiqueinitialeetsur
lesrisquesencourusparlesécosystèmesavecleréchauffementclimatique.
‐Capacitésetattitudes:
VAL:Analyserl’ensembledesrésultatsdefaçoncritique
COM:communiquerdefaçonécrite

S.L‐THEMEL'atmosphèreterrestre
Domaineexploré:L'eauetl'air:couplageatmosphère/géosphère
ANNEXE
L'entréedansleprojetpeutêtreinitiéepardifférentsdocuments.
Texted'unscientifique:RobertKandel,astrophysicienetchercheurauLaboratoiredeMétéorologie
Dynamique(EcolePolytechnique)depuis1985.
Onpeutégalementconsulter:L'humanitéfaceauchangementclimatique,RobertDAUTRAYet
JacquesLESOURME,OdileJacob,novembre2009.
Sitesinternet.
http://www.manicore.com/documentation/serre/acide.html"allons‐noustransformerl'océanenun
lacacide?"
http://www.notre‐planete.info/actualites/actu_713_acidification_oceans.php"l'acidificationdes
océansmenacelesorganismesmarins".
http://www.maxisciences.com/r%E9chauffement‐climatique/rechauffement‐climatique‐des‐puits‐
de‐carbone‐oceaniques‐moins‐efficaces_art557.html"réchauffementclimatique:despuitsde
carbonemoinsefficace".
http://www.ecologie.gouv.fr/‐En‐bref‐les‐enjeux‐du‐changement‐.htmlsynthèsedurapportdu
GIEC.
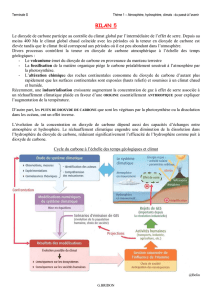
Laproblématique
Bienentendu,onnevisepasàapporteruneréponsedéfinitivemaisàsimulerexpérimentalementce
couplage.
Lesactivitésconduitesconsistentà:
‐mettreenévidencequ'uneaugmentationdeCO2dansl'airaccroîtlepHd'uneeau,à
températureetàpressionconstantes;
‐mettreenévidencequ'unaccroissementdelatempératured'uneeaucontenantduCO2
provoqueundégazageetdoncuneaugmentationdelapressionpartielledegaz
carbonique,àpressiontotaleconstante.
[…]
Une part importante – environ 30 % - de nos émissions de CO2 ne reste pas dans
l'atmosphère car elle se dissout dans l'océan. L'augmentation de CO2 dans l'atmosphère tend
à provoquer un flux naturel de CO2 de l'atmosphère vers l'océan. […]. … le flux additionnel de
l'atmosphère vers l'océan augmente l'acidité de l'eau […], ce qui pose des problèmes pour la
vie marine, en particulier les coraux. Et en même temps l'océan se réchauffe, ce qui diminue
la capacité d'absorption en CO2 . Or les mesures indiquent bien une diminution anthropique
de CO2 transférée de l'air vers les mers – de 31% en 1960 à 25% aujourd'hui. Existe-t-il un
seuil d'acidité et de température de la mer qui, s'il est dépassé, conduira à un renversement
du flux et des dégagements massifs de CO2 de l'océan vers l'atmosphère renforçant
rapidement et fortement l'effet de serre ?
D'après La catastrophe climatique, Robert KANDEL, Maya KANDEL, Hachette littératures,
octobre 2009 (pages 205 et 206).
 6
6
1
/
6
100%