choragon (ferring) - E

CHORAGON
(FERRING)
1. DÉNOMINATION DU MÉDICAMENT
Choragon 5000 UI poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ampoule de Choragon 5000 UI contient 5000 UI de gonadotrophine chorionique.
Pour la liste complète des excipients, voir rubrique: "Liste des excipients".
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable
Aspect de la poudre : agrégat lyophilisé blanc
Aspect du solvant : solution incolore transparente
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Thérapie
Gynécologie
Choragon est indiqué pour le traitement de:
Femmes subissant une superovulation préalable à des techniques de procréation médicalement assistée telles que la fécondation in vitro
(FIV) : Choragon est administré pour provoquer la maturation folliculaire finale et la lutéinisation après la stimulation de la croissance
folliculaire.
Femmes ayant des cycles anovulatoires ou oligo-ovulatoires : Choragon est administré pour provoquer l’ovulation et la lutéinisation
chez des patientes ayant des cycles anovulatoires ou oligo-ovulatoires, après la stimulation de la croissance folliculaire.
Pédiatrie
Retard de puberté chez les garçons.
Diagnostic
Diagnostic différentiel de la cryptorchidie et de l’anorchidie.
Évaluation de la fonction testiculaire chez des patients souffrant d’hypogonadisme hypogonadotrope, avant un traitement de stimulation.
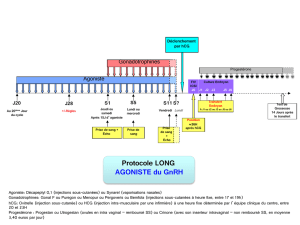
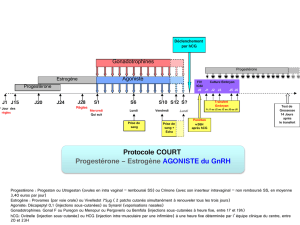
4.2 Posologie et mode d'administration
Gynécologie
Un traitement par Choragon doit s’effectuer sous la supervision d’un médecin ayant l’expérience du traitement des problèmes de
fertilité.
Le schéma posologique suivant doit être utilisé :
Femmes subissant une superovulation préalable à des techniques de procréation médicalement assistée telles que la fécondation in vitro
(FIV) : on administre une ou deux ampoules de Choragon (5000 UI) 24 à 48 heures après la dernière administration d’une préparation
de FSH ou de hMG, c.-à-d. lorsqu’on a atteint la stimulation optimale de la croissance folliculaire.
Femmes avec des cycles anovulatoires ou oligo-ovulatoires : on administre une ou deux ampoules de Choragon (5000 UI) 24 à 48
heures après l’obtention de la stimulation optimale de la croissance folliculaire. On recommande à la patiente d’avoir des rapports
sexuels le jour de l’injection de Choragon et le lendemain.
Pédiatrie et andrologie
Pour l’induction de la puberté chez les garçons souffrant de retard pubertaire, 1 ampoule de Choragon 5000 UI par semaine pendant 3
mois.
Pour le diagnostic différentiel chez les adolescents souffrant d’un testicule non descendu : dose unique de 1 ampoule de Choragon

5000 UI.
Pour l’évaluation de la fonction testiculaire chez les patients souffrant d’hypogonadisme hypogonadotrope : dose unique de 1 ampoule
de Choragon 5000 UI.
Mode d'administration
Choragon est destiné à être administré par voie intramusculaire.
La poudre doit être reconstituée immédiatement avant l'utilisation avec le solvant ci-joint.
4.3 Contre-indications
Générales
Hypersensibilitéà la gonadotrophine chorionique ou à l’un des excipients de Choragon.
Gynécologie
- Tumeurs de l’hypophyse ou de l’hypothalamus.
- Hypertrophie ovarienne ou kystes dus à des motifs autres qu’un syndrome des ovaires polykystiques.
- Hémorragies gynécologiques d’étiologie indéterminée.
- Carcinome ovarien, utérin ou mammaire.
- Grossesse extra-utérine au cours des 3 derniers mois.
- Affections thrombo-emboliques actives.
Choragon ne doit pas être administré s’il est peu probable que l’issue du traitement soit favorable, p.ex. en cas de :
- insuffisance ovarienne primaire,
- malformations des organes sexuels, incompatibles avec une grossesse,
- fibromes utérins, incompatibles avec une grossesse,
- femmes post-ménopausées.
Choragon ne doit pas être administré à des femmes souffrant d’un syndrome d’hyperstimulation ovarienne (SHSO).
Pédiatrie et andrologie
Choragon ne doit pas être utilisé en cas de tumeurs hormonodépendantes.
Choragon ne doit pas être utilisé pour le traitement d’un testicule non descendu dont l’origine organique est établie (hernie inguinale,
chirurgie au niveau de la région inguinale, testicule ectopique).
4.4 Mises en garde spéciales et précautions particulières d’emploi
Générales
Le traitement par HCG entraîne une augmentation de la production d’androgènes et une rétention d’eau. Les patientes souffrant d’une
affection cardiaque ou rénale connue ou suspectée, d’hypertension, d’épilepsie ou de migraine (y compris lors de l’anamnèse) doivent
être suivies attentivement, étant donné que l’utilisation de Choragon peut occasionnellement provoquer une aggravation et une récidive
de ces phénomènes (voir rubrique: "Effets indésirables").
Les patientes présentant des facteurs de risque généralement reconnus d’événements thrombo-emboliques, tels que des antécédents
personnels ou familiaux, une obésité sévère (indice de masse corporelle > 30 kg/m²) ou une thrombophilie peuvent courir un risque
accru d’événements thrombo-emboliques veineux ou artériels, lors d’un traitement par gonadotrophines ou après celui-ci. Chez ces
patientes, les bénéfices de l’administration des gonadotrophines doivent être mis en balance avec les risques. Il faut cependant noter
que la grossesse en elle-même entraîne également un risque accru d’événements thrombo-emboliques.
Gynécologie
Avant l’instauration du traitement, il faut évaluer correctement la cause de l’infertilité et les contre-indications généralement reconnues à
une grossesse. En particulier, les patientes doivent subir un bilan à la recherche d’une hypothyroïdie, d’une insuffisance
corticosurrénalienne, d’une hyperprolactinémie et de tumeurs hypophysaires ou hypothalamiques, et elles doivent recevoir le traitement
spécifique approprié.
Syndrome d’hyperstimulation ovarienne (SHSO)
Les patientes subissant une stimulation de la croissance folliculaire peuvent courir un risque accru de syndrome d’hyperstimulation
ovarienne (SHSO) dû au développement de plusieurs follicules. Le SHSO est un événement médical distinct de l’hypertrophie
ovarienne non compliquée. Le SHSO est un syndrome qui peut se manifester à des degrés croissants de sévérité. Il consiste en une
hypertrophie ovarienne marquée, des taux sériques de stéroïdes sexuels élevés, et une augmentation de la perméabilité vasculaire
pouvant entraîner une accumulation de liquide dans les cavités péritonéale, pleurale, et rarement péricardique.
Les symptômes suivants peuvent s’observer dans les cas sévères de SHSO : douleurs abdominales, distension abdominale,
hypertrophie ovarienne sévère, prise de poids, dyspnée, oligurie et symptômes gastro-intestinaux incluant nausées, vomissements et
diarrhée. L’évaluation clinique peut révéler une hypovolémie, une hémoconcentration, des troubles électrolytiques, de l’ascite, un
hémopéritoine, des épanchements pleuraux, un hydrothorax, une détresse respiratoire aiguë et des événements thrombo-emboliques.

Une réponse ovarienne excessive au traitement par gonadotrophines entraîne rarement un SHSO, à moins qu’on n’administre de
l’HCG pour déclencher l’ovulation. Dès lors, dans les cas d’hyperstimulation ovarienne, il est prudent de différer l’administration
d’HCG et de conseiller à la patiente d’utiliser une méthode contraceptive de barrière ou de s’abstenir de relations sexuelles jusqu’au
début des menstruations suivantes. Le SHSO peut évoluer rapidement (en 24 heures à plusieurs jours) en un événement médical
sérieux, ce qui explique que les patientes doivent être suivies pendant au moins deux semaines après l’administration d’HCG.
Le respect de la posologie recommandée de Choragon et du schéma d’administration, ainsi qu’un suivi attentif du traitement
minimiseront l’incidence d’hyperstimulation ovarienne. Dans le cadre des techniques de procréation médicalement assistée (PMA),
l’aspiration de tous les follicules avant l’ovulation peut réduire la survenue d’hyperstimulation.
Le SHSO peut être plus grave et plus long en cas de grossesse. Le plus souvent, le SHSO se produit après l’arrêt du traitement
hormonal et atteint sa sévérité maximale sept à dix jours après le traitement. Habituellement, le SHSO se résout spontanément avec
l’apparition des menstruations.
En cas de SHSO sévère, le traitement par gonadotrophines sera arrêté, s’il est toujours en cours, la patiente sera hospitalisée et on
débutera un traitement spécifique du SHSO.
Ce syndrome est plus fréquent chez les patientes souffrant d’ovaires polykystiques.
Grossesses multiples
Les grossesses multiples, en particulier de haut rang, entraînent un risque accru d’évolutions maternelles et périnatales défavorables.
Chez les patientes subissant une induction d’ovulation au moyen de gonadotrophines, l’incidence de grossesses multiples est accrue par
rapport aux conceptions naturelles. La majorité des grossesses multiples sont gémellaires. Pour réduire le risque de grossesses
multiples, un suivi attentif de la réponse ovarienne est recommandé.
Chez les patientes subissant un traitement de procréation médicalement assistée (PMA), le risque de grossesse multiple est
essentiellement lié au nombre d’embryons replacés, à leur qualité, et à l’âge de la patiente.
La patiente doit être avertie du risque potentiel de grossesse multiple avant le début du traitement.
Pertes de grossesses
L’incidence de pertes de grossesses par fausse couche ou avortement est plus élevée chez les patientes subissant une stimulation de la
croissance folliculaire lors des procédures de PMA par rapport à la population normale.
Grossesses ectopiques
Les femmes ayant un antécédent de pathologie tubaire courent un risque accru de grossesse ectopique, que la grossesse soit le résultat
d’une conception spontanée ou d’un traitement de la fertilité. La prévalence des grossesses ectopiques après une FIV a été évaluée à 2
à 5 %, contre 1 à 1,5 % dans la population générale.
Tumeurs du système reproducteur
On a rapporté des tumeurs ovariennes et d’autres tumeurs du système reproducteur, tant bénignes que malignes, chez des femmes
ayant subi de multiples traitements médicamenteux en raison d’une infertilité. On n’a pas encore établi si un traitement par
gonadotrophines augmente le risque basal de ces tumeurs chez les femmes souffrant d’infertilité.
Malformations congénitales
La prévalence de malformations congénitales après un traitement de PMA peut être légèrement plus élevée que celle observée après
des conceptions spontanées. On pense que ceci est dû à des différences au niveau des caractéristiques parentales (p. ex. âge maternel,
caractéristiques du sperme) et aux grossesses multiples.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
On n’a pas conduit d’études d’interactions médicamenteuses avec Choragon dans l’espèce humaine.
4.6 Fécondité, grossesse et allaitement
Étant donné l’indication, Choragon ne doit pas être administré durant la grossesse et l’allaitement. On ne dispose pas de données au
sujet de l’excrétion de Choragon dans le lait.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
On n’a pas conduit d’études évaluant les effets sur l’aptitude à conduire et à utiliser des machines. Cependant, il est peu probable que
Choragon ait une influence sur l’aptitude de la patiente à conduire et à utiliser des machines.
4.8 Effets indésirables
Données MedDRA des classes Très fréquent Fréquent Peu fréquent

de systèmes d’organes ( ≥ 1/10) (≥ 1/100 et <1/10) (≥1/1000 et < 1/100)
Affections du système nerveux céphalées
Affections gastro-intestinales nausées, douleur abdominale,
vomissements
diarrhée
Affections de la peau et du tissu
sous-cutané
exanthème, acné vulgaire
Affections endocriniennes
gynécomastie *
Troubles du métabolisme et de la
nutrition
rétention hydro-électrolytique
Troubles généraux et anomalies au
site d’administration
réactions à l’endroit
d’injection
douleur au site d’injection
Affections des organes de
reproduction et du sein
SHSO léger ou modéré SHSO sévère
Affections psychiatriques dépression, irritabilité,
agitation
* Données de littérature rapportées chez les adolescents de sexe masculin
On peut observer une augmentation de la taille du pénis et des érections dues à une augmentation de la sécrétion de testostérone
provoquée par l’induction, et/ou des modifications prolifératives au niveau de la prostate.
Occasionnellement, on peut observer des modifications émotionnelles mineures chez les garçons, similaires à celles survenant au début
de la puberté. Elles disparaissent après l’arrêt du traitement.
Des réactions allergiques y compris l'œdème de Quincke et urticaire ont été rapportées sporadiquement.
La fatigue et la fièvre peuvent parfois être observées après l'administration de Choragon.
4.9 Surdosage
Gynécologie
Aucun cas de surdosage n’a été rapporté. Néanmoins, il est possible qu’un surdosage de Choragon entraîne un syndrome
d’hyperstimulation ovarienne (SHSO) (voir rubrique: "Mises en garde spéciales et précautions particulières d'emploi").
5. PROPRIÉTÉS PHARMACOLOGIQUES
Propriétés pharmacodynamiques
Catégorie pharmacothérapeutique : Gonadotrophines
Code ATC: G03GA01
La Gonadotropine chorionique humaine (HCG) est une glycoprotéine composée d’une chaîne α et d’une chaîne β. L'HCG est
préparée à partir d'urine de femme enceinte. L’effet HCG est qualitativement identique à celui de l’hormone lutéinisante , mais il est
plus forte en raison de sa demi-vie beaucoup plus longue.
Au niveau des ovaires, l'HCG stimule les cellules folliculaires, thécales, stromales et lutéales afin de soutenir la production de
progestérone et d'œstradiol. L’administration d’HCG chez des femmes dont les follicules sont matures induit l’ovulation environ 36
heures après l’injection. La phase lutéale et la phase sécrétoire de l’endomètre peuvent être prolongées grâce à des injections répétées.
Dans les cellules de Leydig, l'HCG stimule la production de testostérone et d'autres stéroïdes sexuels comme la dihydrotestostérone, la
17 OH-progestérone et l'œstradiol. L'administration d'une dose unique de 5000 UI d'HCG chez le garçon et l'homme augmente la
production de testostérone de manière biphasique, avec un premier pic atteint après 2-4 heures et un second entre 48 et 72 heures. La
concentration maximale d'œstradiol dans le sérum est atteinte environ 24 heures après l'administration d'HCG. Ce principe est utilisé
pour le diagnostic différentiel de la cryptorchidie afin de faire la différence entre une cryptorchidie et une anorchidie. Chez les garçons
durant la puberté, l’HCG peut être utilisée pour le traitement d’un retard de descente du testicule.
Propriétés pharmacocinétiques
Après l’injection i.m., la concentration sérique maximale d’HCG est atteint après 4 à 12 heures (dose-dépendant). La demi-vie (t½ β)
est environ 29 à 30 heures. En raison de la lente élimination, l’HCG peut s’accumuler dans le sérum après plusieurs injections
intramusculaires quotidiennes.
L'HCG est métabolisée au niveau rénal; 10-20 % sont retrouvés dans l'urine sous forme inchangée alors que la plus grande partie est
probablement excrétée sous forme de fraction β.

Données de sécurité précliniques
Des expériences animales conduites sur des souris ont montré une augmentation dose-dépendante du nombre de décès embryonnaires
pré-implantation, ainsi que du nombre de décès fœtaux post-implantation, des fœtus plus petits, une diminution du nombre de fœtus par
portée, ainsi qu’une augmentation significative des malformations congénitales (absence de fermeture des paupières, fentes palatines)
après l’administration d’HCG pour l’induction de l’ovulation, aux doses thérapeutiques.
6. DONNÉES PHARMACEUTIQUES
6.1 Liste des excipients
Poudre
Mannitol
Hydroxyde de sodium
Solvant
Chlorure de sodium
Acide hydrochlorique dilué 10 %
Eau pour préparation injectable
6.2 Incompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
6.3 Durée de conservation
La durée de conservation est de 3 ans.
Pour utilisation immédiate et à usage unique après l’ouverture et la reconstitution.
Ce médicament ne doit pas être utilisé après la date d'expiration.
6.4 Précautions particulières de conservation
À conserver à une température ne pas dépassant 25 °C.
6.5 Nature et contenu de l’emballage
Les présentations et conditionnements suivants de Choragon sont disponibles :
Poudre
La poudre pour solution injectable est fournie dans des ampoules brunes en verre.
Solvant
Le solvant pour solution injectable est fourni dans des ampoules incolores en verre de 1 ml.
Les conditionnements suivants de Choragon sont disponibles :
Choragon 5000 UI
Chaque emballage contient 3 ampoules de 5000 unités de poudre d’HCG pour solution injectable, fournies avec 3 ampoules de 1 ml
de solvant de Choragon.
6.6 Instructions pour l’utilisation et la manipulation
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
nv Ferring sa
Capucienenlaan 93C
B-9300 Aalst
8. NUMÉROS D’AUTORISATION DE MISE SUR LE MARCHÉ
Choragon 5000 UI : BE191615
9. DATE DE PREMIÈRE AUTORISATION / DE RENOUVELLEMENT DE L’AUTORISATION
25/10/1999 -
10. DATE DE MISE À JOUR DU TEXTE – D’APPROBATION DU TEXTE
10/2011 – 11/2011
CLASSIFICATION ATC5
 6
6
1
/
6
100%