Chapitre 12 - Précis d`anesthésie cardiaque

Précis d’Anesthésie Cardiaque 2015 – 12 Insuffisance ventriculaire 1
CHAPITRE 12
ANESTHESIE ET
INSUFFISANCE VENTRICULAIRE
Mise à jour: Janvier 2016
Précis d’Anesthésie Cardiaque
PAC
•

Précis d’Anesthésie Cardiaque 2015 – 12 Insuffisance ventriculaire 2
Table des matières
Introduction 2
Epidémiologie 3
Rappel physiopathologique 4
Présentation clinique 20
Insuffisance ventriculaire gauche 20
Insuffisance diastolique 23
Insuffisance ventriculaire droite 26
Traitement de l’insuffisance ventriculaire 31
Insuffisance ventriculaire gauche chronique 31
Défaillance ventriculaire gauche aiguë 35
Insuffisance diastolique 45
Insuffisance ventriculaire droite 46
Resynchronisation 50
Options chirurgicales 52
Assistance ventriculaire 55
Principes, indications, physiopathologie 55
Contre-pulsion intra-aortique 60
ECMO 64
Dispositifs à court-terme 71
Dispositifs à long terme 75
Problèmes liés à une assistance 83
Echo et assistance ventriculaire 86
Anesthésie et assistance ventriculaire 90
Hypertension pulmonaire (HTP) 97
Physiopathologie 97
Clinique de l’HTP 104
Traitement 108
Anesthésie en cas d’insuffisance ventriculaire 115
Evaluation préopératoire 115
Stratégie d’anesthésie 117
Ventilation et insuffisance ventriculaire 123
Agents intraveineux et halogénés 129
Anesthésie générale 134
Anesthésie loco-régionale 137
Insuffisance droite et HTAP 138
Thrombendartérectomie pulmonaire 145
Conclusion 149
Bibliographie 151
Auteurs 163
Introduction
L'insuffisance cardiaque est une notion un peu vague groupant l’ensemble des conditions
hémodynamiques dans lesquelles le débit cardiaque ne suffit plus à satisfaire les besoins énergétiques
de l’organisme, à l'exercice comme au repos. D’une part, les besoins varient avec le stress, le
traumatisme, la douleur, le sommeil ou la pathologie (hyperthyréose, sepsis, etc) ; ils sont modifiés par
les cardiopathies et par l'anesthésie. D’autre part, le terme d’insuffisance cardiaque n’est pas
synonyme de défaillance ventriculaire comme on le sous-entend d’habitude. Dans ce chapitre, nous
parlerons d’insuffisance ventriculaire pour souligner que nous aborderons le sujet sous son angle
uniquement cardiologique et que nous nous concentrerons sur la dysfonction des ventricules à
l’exclusion des autres aspects responsables d’un débit cardiaque inadéquat.
On peut distinguer trois différents types d’insuffisance ventriculaire.
L'insuffisance systolique : l'éjection ventriculaire proprement dite n'assure plus les besoins
hémodynamiques en pression et/ou en volume (Forward failure) ; la symptomatologie est
dominée par l’intolérance à l’effort, la fatigue et la dysfonction éventuelle des organes-cibles.
La stase occasionnée en amont de la pompe ventriculaire caractérise l'insuffisance congestive.
L'insuffisance diastolique : la fonction diastolique étant la capacité du ventricule à
accommoder un remplissage adéquat sous un régime de pression basse et sur un vaste éventail
de conditions de charge, l'insuffisance diastolique se définit comme une résistance au
remplissage ventriculaire (Backward failure). Ceci conduit à une stase en amont, cliniquement
caractérisée par de la dyspnée lors d’insuffisance diastolique gauche et par des oedèmes
périphériques lors d’insuffisance diastolique droite. Alors que la dysfonction systolique
s'accompagne en général d'un certain degré de dysfonction diastolique, l'inverse n'est pas vrai :

Précis d’Anesthésie Cardiaque 2015 – 12 Insuffisance ventriculaire 3
plus du tiers des malades en insuffisance cardiaque congestive souffre en réalité d’insuffisance
diastolique isolée, qui se caractérise par une stase pulmonaire et une fraction d’éjection
conservée (heart failure with preserved ejection fraction, HFpEF) [347,363]. L’insuffisance
diastolique du VD est pour l’instant très difficile à définir et à diagnostiquer.
L'insuffisance restrictive: l’amplitude de mouvement du coeur est diminuée par la
compression péricardique (péricardite constrictive, tamponnade) ou par la compression
thoracique (manoeuvre de Valsalva, PEEP excessive , épanchement pleural, pneumothorax).
Epidémiologie
L'insuffisance ventriculaire est une pathologie fréquente, dont l'incidence et la prévalence sont en
augmentation ces dernières années dans le monde occidental à cause du vieillissement de la
population, mais dont le pronostic est pire que celui de bien des cancers [29,87,142,204].
Prévalence 0.4 - 2 % ;
2.8% > 65 ans, 8% > 80 ans.
Incidence annuelle 3% de 35 à 65 ans ;
10% de 65 à 95 ans.
Rapport hommes / femmes 1.5:1 (insuffisance systolique), 1:2 (insuffisance diastolique)
Mortalité insuffisance systolique : 14% / an, > 60% à 5 ans ;
Insuffisance diastolique : 6-10% / an.
En Suisse, on rencontre ainsi 100’000 patients en insuffisance cardiaque, et on enregistre 20’000
nouveaux cas chaque année [142]. Pour l’Europe, la prévalence globale est de 15 millions de cas [87].
L’insuffisance cardiaque est la deuxième cause d’hospitalisation après l’accouchement [39]. Bien
qu’elle soit la thérapeutique la plus efficace, la transplantation est limitée par le nombre de donneurs,
qui sont en moyenne 3'500 par année dans le monde ; elle concerne donc moins de 1% des cas
[200,327]. D’autre part, l’insuffisance cardiaque prédomine au-delà de 70 ans, âge considéré comme
la limite pour une greffe. La prise en charge repose donc essentiellement sur le traitement médical et
éventuellement sur une assistance ventriculaire.
Dans les pays occidentaux, les causes de l'insuffisance ventriculaire congestive sont dominées par la
cardiopathie ischémique et l’hypertension :
Coronopathie: 50-70%
Hypertension artérielle: 15-30%
Cardiomyopathie du VG: 10%
Valvulopathies: 3-7%
Malformations congénitales: 1-2%
Dans les pays en voie de développement, les cause prédominantes sont les cardiomyopathies
infectieuses (HIV, maladie de Chagas, etc) ou nutritionnelles, les valvulopathies et les affections
congénitales.
Les déterminants cliniques associés à la détérioration des performances myocardiques sont une
dyspnée d'effort, une fatigabilité importante et une tachycardie au repos ; le risque périopératoire est
directement lié à la sévérité de ces symptômes. Parmi les investigations habituelles, les meilleurs
prédicteurs de la mortalité et des complications cardiaques postopératoires sont la capacité vitale, la
fraction d'éjection et le taux de BNP, quelles que soient les méthodes utilisées pour leur évaluation.

Précis d’Anesthésie Cardiaque 2015 – 12 Insuffisance ventriculaire 4
Epidémiologie de l’insuffisance ventriculaire
Définition de l’insuffisance ventriculaire: dysfonction du VG et/ou du VD se traduisant par une
incapacité à maintenir un débit sanguin suffisant pour assurer un fonctionnement adéquat des organes
tout en maintenant des pressions de remplissages normales
Prévalence en augmentation avec l’âge: 1% < 65 ans, 10% > 80 ans
Mortalité de l’insuffisance systolique: 8-14% / an
Mortalité de l’insuffisance diastolique: 6-10% / an
Rappel physiopathologique
L’insuffisance cardiaque est un syndrome dans lequel le cœur ne parvient plus à satisfaire les besoins
hémodynamiques de l’individu. Au niveau myocardique, elle se caractérise par une réduction de la
contractilité intrinsèque et/ou un défaut de la relaxation du muscle ventriculaire; elle s’accompagne
d’un remodelage ventriculaire qui contribue à l’altération fonctionnelle : hypertrophie, dilatation,
fibrose [39]. La physiopathologie est abordée plus en détail au Chapitre 5 (Couplage excitation-
contraction, Dysfonction ventriculaire gauche systolique, Physiopathologie de la diastole, et Fonction
du VD). Ne figure ici qu’un résumé succinct de ces données.
Niveau cellulaire
Au niveau de la cellule myocardique, la défaillance inotrope se caractérise par plusieurs
dysfonctionnements (Figure 12.1) [42,44,254,275,315].
La composante inhibitrice de la protéine G accouplée aux récepteurs β a un effet
prédominant ; de ce fait, la quantité d’AMPc synthétisé est moindre, ce qui conduit à une plus
faible quantité de Ca2+ libéré dans le sarcoplasme par le réticulum sarcoplasmique (RS) lors de
chaque stimulation. Les variations systoliques de la concentration de Ca2+ sont moins amples.
La recapture du Ca2+ libéré par le RS lors de l’excitation est diminuée à cause d’une
suractivité du phospholamban et d’une baisse d’activité de la SERCA (SarcoEndoplasmic
Reticulum Calcium ATPase) ; de plus, le RS laisse fuir du Ca2+ dans le cytoplasme. De ce fait,
il y a moins de Ca2+ à disposition pour la systole suivante dans le RS.
Le site membranaire échangeur Na+/Ca2+ dysfonctionne et laisse entrer trop de Ca2+ dans le
cytoplasme.
Le résultat est une accumulation de Ca2+ dans le cytoplasme, mais une réduction des variations
de la [Ca2+]i entre la systole et la diastole, d’où un retard de relaxation (effet lusitrope négatif)
et un défaut de contractilité (effet inotrope négatif).
La stimulation β1 constante induit une activité excessive du système d’inhibition des
récepteurs ; la cellule est désensibilisée à la stimulation β.
La sur-stimulation sympathique chronique entraîne une diminution (down-regulation) du
nombre des récepteurs β1 (inotropes positifs). En compensation, la proportion des récepteurs
β2 et α1 augmente ; les récepteurs β2 sont chronotropes positifs et faiblement inotropes
positifs ; les récepteurs α1 sont inotropes positifs par une voie indépendante de l’AMPc [302].
o Récepteurs β1 : normalement 80%, insuffisance ventriculaire 40% ;
o Récepteurs β2 : normalement 10%, insuffisance ventriculaire 40% ;
o Récepteurs α1 : normalement 10%, insuffisance ventriculaire 20%.
Le β-blocage chronique freine la désensibilisation des récepteurs et maintient une réponse
physiologique à la stimulation β.

Précis d’Anesthésie Cardiaque 2015 – 12 Insuffisance ventriculaire 5
Les substances cardiotoniques agissent en différents points de ce système (Figure 12.2). Les effets des
catécholamines sont modifiés. La réponse aux amines β1 (dopamine, dobutamine) est diminuée par
manque de récepteurs β1, alors que l'adrénaline, qui stimule les récepteurs β1, β2 et α1, conserve son
activité inotrope et chronotrope puisque les récepteurs β2 et α1 sont en surnombre. La noradrénaline
(effet α1 majeur et β1 secondaire) a davantage d’effet inotrope positif que sur un coeur normal à cause
de l’augmentation de la proportion des récepteurs α. Les substances qui court-circuitent le système
récepteur β – AMPc comme les α-stimulants, les inhibiteurs des phosphodiestérases-3 (amrinone,
milrinone) ou le levosimendan gardent leur efficacité en cas d’insuffisance ventriculaire chronique ou
de β-blocage [225].
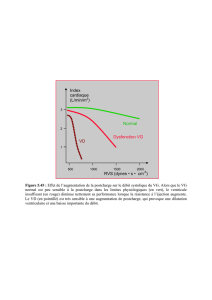
Relation avec la précharge
La courbe de Frank-Starling d’un ventricule gauche insuffisant présente trois caractéristiques par
rapport à la courbe normale (Figure 12.3) :
Déplacement de la courbe vers le bas (basse performance systolique) et vers la droite (haut
volume de remplissage) ;
Figure 12.1: Schéma des
modifications du couplage
excitation – contraction an cas
d’insuffisance ventriculaire. La
surstimulation sympathique
induit une désensibilisation des
récepteurs β. La protéine G
inhibitrice des récepteurs β est
prédominante et la quantité
d’AMPc synthétisé est moindre,
d’où baisse des variations
systolo-diastoliques de la
[Ca2+]i, car le réticulum sarco-
plasmique (RS), qui libère le
Ca2+ en systole, est appauvrit en
calcium. La recapture du Ca2+
libéré par le RS est diminuée à
cause d’une suractivité du
phospholamban et d’une baisse
d’activité de la SERCA ; de
plus, le RS laisse fuir du Ca2+
dans le cytoplasme. Le site
membranaire échangeur
Na+/Ca2+ dysfonctionne et
laisse entrer trop de Ca2+ dans
le cytoplasme. Le résultat est
une concentration cytoplas-
mique de Ca2+ libre trop élevée,
mais des variations systolo-
diastoliques de la [Ca2+]i trop
faibles par rapport à la norme
(pointillé), parce que le RS
n’est pas suffisamment rechargé
en Ca2+. La force de contraction
diminue, la relaxation est moins
performante.
ATP
G
i
Phospho-
diestérases
10-5
10-6
10-7
10-8
[Ca++]
Echange
Na+/Ca+ +
[Ca++]
G
s
Mi
t
Troponine C
R
S
Actine - myosine
AMP
Protéine-kinase A
[Ca++]
Canal Ca+ +
ΔV dépendant
P
Récepteurs β ↓
↓ Δ [Ca++]
© Chassot 2015
↑ [Ca++]
↓ ATP
R-Ry
G
i
cAMP
⇓'
↑ β ARC
R-Ry
SERCA
↓ [Ca++]
↓ Δ[Ca++]
P
Gi
Phospholamban ↑
Δ [Ca++]
sarcoplasmique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
1
/
163
100%