Le récepteur des protéines résidentes du réticulum - iPubli

702
NOUVELLES
Le récepteur des protéines résidentes
du réticulum endoplasmique
°
[
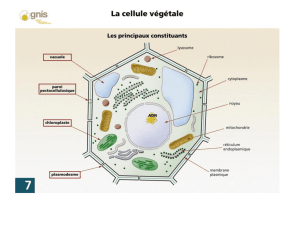
Golgi
Figure

à
à
à
à
à à
à
à
L,
° 7 vol.
C
c-s
à
(mis °
à
î
p
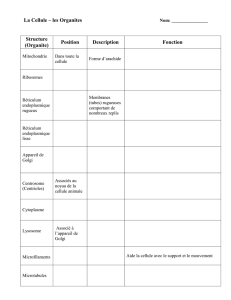
Figure
703
1
/
2
100%