RESUME DES CARACTERISTIQUES DU PRODUIT 1
publicité

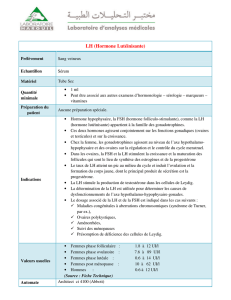
RCP – Version FR PLUSET RESUME DES CARACTERISTIQUES DU PRODUIT 1. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE PLUSET Poudre et solvant pour solution injectable 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Poudre Un flacon contient: Substance(s) active(s) : Hormone folliculostimulante porcine (FSHp).........500 UI Hormone lutéinisante porcine (LHp)..................... 500 UI Solvant Un flacon contient: Excipient(s): Chlorocrésol0,021 g Sterile, pyrogen-free, normal saline21 ml Solution reconstituée: Un ml contient : Substance(s) active(s) : Hormone folliculostimulante porcine (FSHp).......... 50 UI Hormone lutéinisante porcine (LHp)....................... 50 UI Excipient(s) : Chlorocrésol1 mg Sterile, pyrogen-free, normal saline1 ml Pour la liste complète des excipients, voir rubrique « liste des excipients ». 3. FORME PHARMACEUTIQUE Poudre et solvant pour solution injectable. Pastille blanche à blanc cassé et solution limpide et incolore. 4. INFORMATIONS CLINIQUES 4.1. Espèces cibles Bovins (femelles sexuellement matures). 4.2. Indications d’utilisation, en spécifiant les espèces cibles Chez les génisses et les vaches sexuellement matures : - Induction d’une superovulation. 4.3. Contre-indications Ne pas utiliser en cas d’hypersensibilité au principe actif ou à l’un des excipients. Ne pas utiliser chez les mâles et les femelles immatures pour la reproduction. RCP – Version FR PLUSET Voir rubrique « Utilisation en cas de gravidité, de lactation ou de ponte ». 4.4. Mises en garde particulières à chaque espèce cible Aucune. 4.5. Précautions particulières d’emploi i) Précautions particulières d’emploi chez l’animal Les recommandations suivantes doivent être suivies pour induire la superovulation avec une réponse adéquate: a. L’animal donneur doit avoir eu au moins un cycle oestral normal avant de commencer le traitement. b. L’animal donneur doit être en bonne santé. L’examen des ovaires doit avoir confirmé la présence d’un corps jaune fonctionnel et l’absence d’anomalie pathologique comme des kystes ovariens ou des adhérences ovariennes. c. Le traitement doit commencer entre les 9ème et 12ème jour du cycle œstral (le mieux étant le 11ème jour). d. Une dose lutéolytique de prostaglandine F 2 alpha (ou d’un médicament analogue) doit être administrée par voie intramusculaire 60 et/ou 72 heures après le début du traitement superovulatoire. e. L’œstrus apparaîtra entre 40 et 48 heures après le traitement à base de prostaglandine. Les animaux doivent être inséminés 12 h après le début de l’immobilisation au chevauchement puis une nouvelle fois 12 h plus tard avec du sperme de haute qualité. f. Après la récupération non-chirurgicale des embryons le 7 ème jour, un nouveau traitement à base de prostaglandine est recommandé afin de permettre un retour en chaleur rapide ; une alternative consiste à examiner les animaux quatre semaines plus tard afin de s’assurer du rétablissement d’une activité ovarienne normale. La femelle peut être mise à la reproduction dès les premières chaleurs après la superovulation, qui surviennent généralement 28 jours plus tard. g. L’effet de traitements superovulatoires répétés pendant une longue période n’ont pas été évalués. Par conséquent, on recommande de ne pas faire plus de deux traitements superovulatoires. On recommande par ailleurs de laisser passer au moins un cycle oestral naturel entre les deux traitements de superovulation. h. L’intervalle entre le vêlage et le début du traitement superovulatoire doit être au moins de 3 mois. i. Une variabilité interindividuelle des réponses au traitement selon l’âge, la race, et le statut physiologique peut être observée. Précautions particulières à prendre par la personne qui administre le médicament aux animaux Une auto-injection accidentelle peut provoquer des effets biologiques chez la femme et le fœtus. Le médicament doit être manipulé avec précaution afin d’éviter une auto-injection. En cas d’autoinjection accidentelle chez des femmes enceintes ou potentiellement enceintes, il est recommandé de demander conseil à un médecin et montrer lui la notice ou l’étiquette. 4.6. Effets indésirables (fréquence et gravité) Légère réduction de la production laitière. Après le traitement, un décalage du retour en chaleur peut avoir lieu. RCP – Version FR PLUSET L’induction de superovulation peut provoquer l’apparition de kystes ovariens. 4.7. Utilisation en cas de gravidité, de lactation ou de ponte Ne pas utiliser durant la gestation. Une légère réduction de la production laitière a été observée pendant les chaleurs induites par la superovulation (comme pour les autres chaleurs), mais elle retrouve un niveau équivalent à celui avant traitement en moins de deux semaines. 4.8. Interactions médicamenteuses et autres formes d’interaction Aucune connue. 4.9. Posologie et voie d’administration Dissoudre chaque flacon de poudre dans 10.5 ml de solvant. Respecter les conditions habituelles d’asepsie pendant la reconstitution du produit et pendant le prélèvement des doses dans le flacon. Nettoyer et désinfecter le bouchon du flacon avant chaque prélèvement et utiliser pour cela des aiguilles stériles. Agitez doucement pendant la reconstitution. Administrer par voie intramusculaire uniquement. Le protocole de traitement suivant est recommandé pour l’induction de la superovulation chez la vache: La dose totale recommandée est de 800 à 1000 UI en doses décroissantes pendant 4 à 5 jours. Le dosage et le programme de traitement doivent être adaptés en fonction de la variabilité entre animaux et en prenant en compte la race, l’âge et le statut physiologique. Il est donc recommandé de demander conseil à un vétérinaire pour le choix des dosages. Pour les génisses et les vaches allaitantes, la dose totale recommandée est de 800 UI. Pour les vaches laitières, la dose peut être augmentée à 1000 UI, en prenant en compte l’âge, le rang de vêlage et la production laitière. Protocole recommandé pour une dose de 800 UI en 4 jours : Jour 1* Jour 2 Jour 3** Jour 4 08:00 h 20:00 h 08:00 h 20:00 h 08:00 h 20:00 h 08:00 h 20:00 h 3.0 ml i.m. 3.0 ml i.m. 2.5 ml i.m. 2.5 ml i.m. 1.5 ml i.m. 1.5 ml i.m 1.0 ml i.m. 1.0 ml i.m. (150 UI FSH + 150 UI LH) (150 UI FSH + 150 UI LH) (125 UI FSH + 125 UI LH) (125 UI FSH + 125 UI LH) (75 UI FSH + 75 UI LH) (75 UI FSH + 75 UI LH) (50 UI FSH + 50 UI LH) (50 UI FSH + 50 UI LH) Protocole recommandé pour une dose de 1000 UI en 5 jours : Jour 1* Jour 2 Jour 3** Jour 4 08:00 h 20 :00 h 08:00 h 20 :00 h 08:00 h 20 :00 h 08:00 h 3.0 ml i.m. 3.0 ml i.m. 2.5 ml i.m. 2.5 ml i.m. 2.0 ml i.m. 2.0 ml i.m. 1.5 ml i.m. (150 UI FSH + 150 UI LH) (150 UI FSH + 150 UI LH) (125 UI FSH + 125 UI LH) (125 UI FSH + 125 UI LH) (100 UI FSH + 100 UI LH) (100 UI FSH + 100 UI LH) (75 UI FSH + 75 UI LH) RCP – Version FR Jour 5 PLUSET 20 :00 h 08:00 h 20 :00 h 1.5 ml i.m. 1.0 ml i.m. 1.0 ml i.m. (75 UI FSH + 75 UI LH) (50 UI FSH + 50 UI LH) (50 UI FSH + 50 UI LH) * correspond au 11ème jour du cycle oestral. **une dose lutéolytique de prostaglandine F2 alpha doit être administrée par voie intramusculaire 60 et/ou 72 heures après le début du traitement superovulatoire. 4.10. Surdosage (symptômes, conduite d’urgence, antidotes), si nécessaire Il est déconseillé de dépasser la dose maximale recommandée. Des doses élevés de FSH et LH peuvent être associées à une réduction des taux de fécondation, ce qui amène a une augmentation des ovocytes non fécondés. 4.11. Temps d’attente Bovins : Viande et abats: zéro jours. Lait: zéro heures. 5. PROPRIÉTÉS PHARMACOLOGIQUES Groupe pharmacothérapeutique: Hormones sexuelles et modulateurs de l’appareil génital. Gonadotrophines Code ATC-vet : QG03GA90 5.1. Propriétés pharmacodynamiques Les FSH et LH porcines sont des glycoprotéines sécrétées par l’hypophyse antérieure sous l’influence de la GnRH libérée par l’hypothalamus. Ces protéines se composent d’une sous-unité alpha et d’une sous-unité béta; la spécificité biologique réside dans l’unité beta (poids moléculaire = 27,000 34,000). FSH et LH stimulent les fonctions gonadiques normales et la sécrétion des hormones sexuelles chez les mammifères mâles et femelles. Chez les femelles, pendant le cycle oestral, la FSH stimule le développement et la maturation des follicules de Graff et de l’ovocyte. Les follicules répondent par une augmentation de la sécrétion oestrogénique des cellules de la thèque interne entourant le follicule qui, au milieu du cycle, stimulent la libération de la LH hypophysaire par un mécanisme de rétrocontrôle. L’augmentation de la sécrétion d’œstrogène et de LH hypophysaire provoque la rupture du follicule et par conséquent l’ovulation. Le follicule est transformé en un corps jaune qui secrète la progestérone. L’administration de gonadotrophines exogènes, FSH et LH, permet d’augmenter le taux d’ovulation. On suppose que l’administration de gonadotrophines exogènes augmente le nombre de follicules à antrum et diminue le nombre de follicules atrétiques. Un rapport FSH/LH adapté et un protocole (programme) de traitement approprié sont essentiels pour obtenir la superovulation. Lorsque que la FSH stimule la croissance folliculaire, il a été montré qu’une petite quantité de LH est nécessaire pour obtenir des ovulations multiples. Bien que la proportion d’activité FSH/LH du produit soit maintenue à 50/50, son activité principale est la stimulation folliculaire en raison de la courte demi-vie de la LH porcine. 5.2. Caractéristiques pharmacocinétiques Les gonadotrophines FSH et LH ont une structure moléculaire comparable chez toutes les espèces de mammifères, avec seulement quelques petites différences structurelles. Par conséquent, les FSH et LH d’origine porcine seront métabolisées et excrétées comme des gonadotrophines endogènes. RCP – Version FR PLUSET Les FSH et LH qu’elles soient endogènes ou exogènes sont éliminées de l’organisme principalement par le rein. Les hormones glycoprotéiques subissent une filtration glomérulaire, suivie soit (a) par une excrétion (en grande partie de molécule non transformée) dans l’urine ou bien (b) d’une dégradation par les cellules du tubule contourné proximal. L’hormone protéique filtrée est réabsorbée (par endocytose) et elle est catabolisée en oligopeptides et en acides aminés libres dans les lysosomes. Les acides aminés libérés passent ensuite dans le sang par la circulation peritubulaire. La cinétique de la FSH-p et de la LH-p chez les bovins est représentée par une courbe biexponentielle avec un temps d’élimination initiale rapide (t½ α) suivi par une lente diminution (t ½ β) dans le sang. Les valeurs de demi-vie de la FSH-p sont de 2.5 h (t½ α) et de 25.5 h (t ½ β) respectivement, déterminés après une administration i.v. unique à deux génisses. Les valeurs pour la LH-p sont respectivement de 40 min et de 6 h. 6. INFORMATIONS PHARMACEUTIQUES 6.1. Liste des excipients Chlorocrésol Chlorure de sodium Eau pour préparations injectables 6.2. Incompatibilités Aucune connues. 6.3. Durée de conservation Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans. Durée de conservation après reconstitution conforme aux instructions : 6 jours. 6.4. Précautions particulières de conservation À conserver en dessous de 25°C. Après reconstitution, à conserver et transporter réfrigéré (entre +2°C et +8°C) et ne pas congeler. Conserver le flacon dans l’emballage extérieur. 6.5. Nature et composition du conditionnement primaire FR : Flacon verre type I Bouchon bromobutyl et silicate (poudre) Bouchon caoutchouc (solvant) Capsule aluminium BE : Conditionnement pour le produit lyophilisé : - Flacon en verre neutre et incolore (type 1). Capacité : 10 ml. Avec un bouchon en bromobutyl et silicate et un capuchon flip off seal en aluminium. Conditionnement pour le solvant : - Flacon en verre neutre et incolore (type 1). Capacité : 21 ml. Avec un bouchon peni-type en caoutchouc de couleur grise et un capuchon flip off seal en aluminium. Boîte en carton avec 2 flacons en verre de 10 ml de produit lyophilisé et 1 flacon en verre de 21 ml de solvant. RCP – Version FR PLUSET 6.6. Précautions particulières à prendre lors de l’élimination de médicaments non utilisés ou de déchets dérivés de l’utilisation de ces médicaments Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets. 7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ LABORATORIOS CALIER BARCELONES, 26 (PLA DEL RAMASSA) LES FRANQUESES DEL VALLES 08520 BARCELONA ESPAGNE 8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ BE : BE-V319724 FR : FR/V/6873293 2/2008 Boîte de 2 flacons de poudre et de 1 flacon de 20 mL de solvant. Toutes les présentations peuvent ne pas être commercialisées. 9. DATE DE PREMIÈRE AUTORISATION OU DE RENOUVELLEMENT DE L’AUTORISATION Date de première autorisation : 23/06/2008 Date de renouvellement de l’autorisation : 02/03/2009 10. DATE DE MISE À JOUR DU TEXTE 29/09/2016 INTERDICTION DE VENTE, DE DÉLIVRANCE ET/OU D'UTILISATION À ne délivrer que sur ordonnance vétérinaire