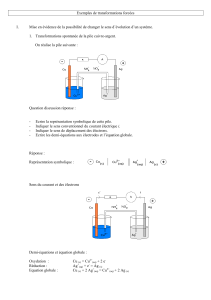
Introduction - Nathalie Rion

Montage n° 19
Expériences portant sur les courbes intensité-potentiel ; applications.
Introduction
Nous pouvons étudier les réactions d’oxydoréduction d’un unique point de vue thermodynamique
(potentiels rédox, loi de Nernst, diagramme potentiel/pH…). Comment expliquer, dans ce cas,
qu’une solution de permanganate de potassium ou qu’une solution d’eau oxygénée soient
stables alors que la thermodynamique prévoit le contraire ? Comment expliquer que l’électrolyse
d’une solution de chlorure de sodium permette la formation de dichlore à l’anode, alors que la
thermodynamique prévoit la formation de dihydrogène ? Nous allons rechercher l’explication de
ces « anomalies » du côté des phénomènes cinétiques qui accompagnent bien évidemment les
réactions d’oxydoréduction. Pour faire cette étude cinétique, nous allons nous intéresser aux
courbes intensité-potentiel ; en effet, l’intensité traversant l’électrode est directement
proportionnelle à la vitesse des processus électrochimiques ayant lieu au voisinage de l’électrode.
I. Electrolyse de l’eau
100 Manip n°50 p.154
Nous allons réaliser l’électrolyse d’une solution d’acide sulfurique à 1 mol.L-1.
E° (V)
S2O82- / SO42- -- 2,00
O2 / H2O -- 1,23
H+ / H2 -- 0
Matériel : cuve à électrolyse, ampèremètre, voltmètre, électrodes en
graphite et en platine.
Essayons de prévoir la réaction d’un point de vue théorique. En
solution, on a les ions sulfates et l’eau (H2O et H+). L’électrolyse que
je vais réaliser et la réaction entre H2O et H+ qui va donne O2 et H2.
Le pH étant à 0, je devrai imposer une ddp=1,23 V pour que la
réaction se fasse.
I.1 Electrodes de platine
On augmente progressivement la ddp et on regarde ce qui se passe au niveau des électrodes. La
réaction démarre lorsqu’on observe un dégagement gazeux sur les électrodes.
A la ddp théorique de 1,23 V prévu par la thermo : toujours rien.
On a quelque chose pour ddp=2V environ (vérifier qu’il y a du courant avec ampèremètre).
I.2 Electrodes de graphite
Idem.
La ddp sera cette fois-ci supérieure à 2V
Interprétation : Pourquoi a-t’on une ddp supérieure à la ddp théorique ? Pourquoi cette ddp n’est-
elle pas la même sur graphite et sur platine ?
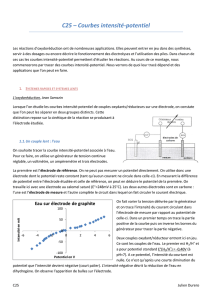
I.3 Courbes intensité-potentiel
Sarrazin p.232
Pour tenter de comprendre ce phénomène, nous allons étudier chaque ½ réaction à l’aide des
courbes intensité-potentiel.
Principe de la mesure : on réalise
un montage à 3 électrodes : on
impose une ddp entre une
électrode de référence (qui
gardera un potentiel constant au
cours de l’expérience) et notre
électrode de travail
(successivement platine et
carbone). On mesure ensuite le
courant qui circule dans l’électrode
de travail grâce à une 3ème
électrode, appelée électrode
auxiliaire ou contre-électrode pour

fermer le circuit.
On observe des courbes de type exponentielles. Plus on impose une tension importante, plus le
courant est grand, donc plus la vitesse de la réaction qui se passe au niveau de l’électrode est
rapide. I.3.1 étude de la réduction de l’eau (cathode) :
2 H3O+ + 2e- = H2 + 2 H2O
En théorie, le dégagement de H2 doit se faire à E=E°
- 0,06 pH=0V
Sur platine, on lit sur la courbe que le potentiel à
imposer correspond à celui du couple H+/H2.
I.3.2 étude de l’oxydation de l’eau (anode) :
H2O = ½ O2 + 2H+ + 2e-
En théorie, le dégagement de O2 doit se faire à
E=E°+0,03log[H+]2pO21/2=1,23-0,06 pH=1,23. Mais
ce n’est pas ce qu’on lit sur la courbe. On commence à voir apparaître un courant pour un tension
bien supérieure. Donc il faut appliquer une tension supérieure à celle prévue par la
thermodynamique. Il existe donc des surtensions.
On mesure les surtensions pour une valeur de courant donnée.
Rq : on peut aussi mesurer les surtensions directement dans la cuve à électrolyse à l’aide d’une ECS.
I.3.3 Influence du type d’électrode
Les surtensions ne sont pas les mêmes avec les 2
électrodes. Donc d’un point de vue industriel,
lorsqu’on réalise une électrolyse, il est intéressant de
connaître le comportement d’un couple sur les
différentes électrodes pour minimiser les surtensions
à appliquer.
Pourquoi ces surtensions ? Pour que la réaction ait lieu, il
faut imposer une ddp supérieure au potentiel d’équilibre du
couple. On visualise ici un des aspects cinétiques des réactions
d’oxydoréduction = transfert de charge. En effet, l’eau doit
transférer ses électrons avec l’électrode. Si l’électrode est
recouverte d’oxydes, ce transfert est ralenti. On qualifie ces
système de systèmes lents.
Tous les systèmes ont-il ce comportement ou existe t-il des
systèmes (couple/électrode) pour lesquels les paramètres
cinétiques sont négligeables ?
Eimposée = Ethermo + surtensions + rI
II. Etude d’un système rapide
100 Manip n°59 p.169
On visualise un système rapide, sans surtension. Il existe
donc 2 types de systèmes : les systèmes rapides et les
systèmes lents. Fe3+ + e- Fe2+
On a ici uniquement un échange d’électrons. Dans le cas
de l’eau, il y a des ruptures au niveau des molécules (ce
n’est pas simplement un échange d’e-), ce qui peut
expliquer le fait qu’un couple soit rapide ou lent.
On visualise également sur ces courbes (qui ne sont pas
de simples exponentielles, mais qui possèdent un palier),
ce qu’on appelle un palier de diffusion. Quand le régime
stationnaire est atteint, c’est le transfert de matière qui
devient le facteur limitant. Celui-ci peut avoir lieu sous
trois formes : - migration des ions (action d’un champ
électrique)
- convection (action d’une agitation mécanique notamment)

- diffusion (action d’un gradient de concentration)
III. Applications
III.1 Corrosion du fer – protection par anode sacrificielle
Sarrazin p.287 - 100 Manip n°61.3 p.173 – Le Maréchal p.218
Réaliser l’expérience. Constater que dégagement sur Zn supérieur au dégagement sur le
fer. Relier ensemble Zn et fer : on constate que c’est Zn qui est corrodé. Dégagement de
H2 sur le fer. Prendre la ddp entre le clou et ECS (pour retrouver la valeur dans la partie
explicative suivante)
Explication par les courbes i-E qui l’on trace au tableau.
III.2 Passivation du fer
Sarrazin p.236 - 100 Manip n°61.3 p.173 – Le Maréchal p.220
III.2.1 Action de l'acide nitrique dilué sur le fer :
Dans un petit becher introduire de l'acide nitrique 5 M. A l'aide d'une pince en bois y plonger la
moitié inférieure d'un clou pendant quelques secondes. On observe l'attaque rapide du fer, la
solution prend une teinte rouille (Fe3+) et d'abondantes vapeurs rousses (NO2) se forment.
Retirer le clou et le rincer dans un becher d'eau. Garder le clou.
III.2.2 Action de l'acide nitrique fumant sur le fer :
Procéder exactement de la même manière que précédemment. Quand le clou entre en contact
avec l'acide fumant l'attaque à lieu mais elle s'arrête presque immédiatement. Retirer le clou et
comparer son aspect avec le précédant. On constate qu'il prend un aspect très brillant (presque
argenté). L'oxydation à produit ici une pellicule d'oxyde magnétique de fer Fe3O4 qui protège le
fer et la réaction s'arrête, c'est le phénomène de passivation. Montrer cette protection en
replongeant le clou dans l'acide dilué, l'attaque n'a plus lieu. On peut montrer la fragilité de cette
protection, il suffit de percer la pellicule d'oxyde en touchant le clou avec une baguette de verre ou
un fil métallique pour que l'attaque reprenne immédiatement. (il se produit un phénomène de
micro-pile ). Cette passivation permet le transport de l'acide nitrique fumant dans des fûts de fer.
III.2.3 Tracer la courbe i-E du fer
III.2.4 Interpréter l’expérience au vu de la courbe i-E
Conclusion
Nous avons vu dans ce montage que lors des études cinétiques en oxydoréduction, il est
impossible de dissocier le couple et l’électrode. Il existe 2 types de systèmes : les systèmes lents
pour lesquels il faut appliquer des surtensions pour que la réaction ait lieu, et les systèmes
rapides. Les courbes intensité-potentiel sont indispensables pour prévoir les réactions qui auront
lieu dans l’électrolyseur et pour choisir les électrodes les mieux adaptées afin de réduire les coût
de fabrication en imposant une ddp la + faible possible.
Ainsi, pour la synthèse du dichlore, à partir de l’électrolyse d’une solution de NaCl, nous
travaillerons avec une électrode de graphite à l’anode pour privilégier la synthèse du dichlore par
rapport à la synthèse du dihydrogène, car l’oxydation de l’eau est très lente sur électrode de
carbone.

BIBLIO
Sarrazin
Le Maréchal
100 manip
Questions
Q1 : Que faut-il faire pour diminuer la résistance de la solution et minimiser les chutes ohmiques ?
R1 : il faut que la solution soit la + conductrice possible. Si besoin, ajouter un électrolyte support
qui n’aura aucune action chimique avec les éléments en solution ou les électrodes.
Q2 : l’oxydation de H2O en O2 se fait à 2V. E°( S2O82- / SO42-)=2V. Pourquoi n’a t’on pas
l’oxydation de ce couple à cette ddp ?
R2 : car on a aussi des surtensions pour ce couple.
Q3 : que signifie l’indication 30vol sur une bouteille d’eau oxygénée ?
R3 : 1 L de H2O2 libère 30 L de O2
Q4 : quelle est l’influence du pH sur les courbes i-E ?
R4 : E dépend du pH
Q5 : pourquoi travailler avec un montage à 3 électrodes ?
R5 : pour que l’électrode de référence reste à un potentiel constant et joue son rôle de référence,
il ne faut pas qu’elle soit traversée par un courant.
Q6 : que se passe-t’il à l’électrode auxiliaire ? la réaction qui s’y passe nous intéresse t’elle ?
R6 : non. Seule celle qui se passe à l’électrode de W nous intéresse.
Q7 : on utilise une solution d’acide sulfurique à 1M. Si on utilisait une solution à 10-1 ou 10-2, que
faudrait-il ajouter ?
R7 : un électrolyte support pour diminuer la résistance de la solution et pour permettre aux
courants de diffusion, de convection et de migration de se déplacer.
Q8 : Est-ce que les espèces électroactives participent à
la migration dans le cas d’un électrolyte support ?
R8 : non. Ce sont les espèces de l’électrolyte support
qui participent.
Q9 : Corrosion du fer – protection par anode
sacrificielle. La tension mesurée entre clou et ECS

= -0,910V, soit -0,665V par rapport à ESH. Est-ce en accord avec le graphe Zn et Fe ?
R9 : oui : on a bien -0,76 < -0.66>-0.44 V
Q10 : qu’est-ce que la protection cathodique par courant imposé ?
R10 : on impose une ddp pour se trouver à un courant inférieur au courant d’oxydation. Dans les
bateaux, on n’utilise pas cette méthode car elle nécessiterait une batterie. On utilise des
parties en Zn sur le bateau, ou en fait trainer des barres de Zn dans l’eau de mer (anode
sacrificielle.
Q11 : dans quel domaine se trouve le fer lors d’une protection cathodique ?
R11 : immunité
Q12 : et dans le cas de la protection anodique ?
R12 : passivation
Q13 : comment doit être l’état de surface du fer après avoir été trempé dans l’acide nitrique
fumant
R13 : une couche d’oxyde protège le fer de la corrosion. Pour que la protection soit efficace, il faut
que cette couche soit imperméable.
Q14 : quels sont les autres systèmes de protection du fer ?
R14 : le revêtement par un métal +noble (pbl dans le cas de piqures dans le métal noble, car le fer
se corrode) ou par un métal – noble. Dans ce cas, c’est Zn par exemple qui se corrode . il
disparaît donc au bout d’un moment. Dans le cas de piqures, le fer sera tjs protégé car tjs en
contact avec le zinc.
Les étapes cinétiquement déterminantes peuvent être de deux natures : le transfert de charge et
le transfert de matière. Quand le régime stationnaire est atteint, c’est le transfert de matière
qui devient le facteur limitant. Celui-ci peut avoir lieu sous trois formes :
- migration des ions (action d’un champ électrique)
- convection (action d’une agitation mécanique notamment)
- diffusion (action d’un gradient de concentration)
Les deux premiers phénomènes peuvent être supprimés : la migration, en utilisant un électrolyte
support en plus grande concentration ; la convection, en supprimant autant que faire se peut
tout mouvement dans la cellule d’étude.
Quant au troisième, il sera toujours à prendre en considération et conduira à l’obtention d’un palier
de diffusion ; toutefois si le réactif considéré est le solvant ou si l’électrode est partie prenante
de la réaction électrochimique, la diffusion n’est plus cinétiquement déterminante.
1
/
5
100%