endocrinologie de la reproduction781.32 KB

Endocrinologie de la reproduction (Delaunay 2010-2011) Page 1
ENDOCRINOLOGIE DE LA REPRODUCTION
La reproduction des vertébrés met en jeu des mécanismes que l’on retrouve chez tous les vertébrés et des
adaptations particulières en fonction des couples. Contrôle hormonal mettant en jeu des hormones stéroïdes et
peptidiques mais également des hormones thyroïdiennes ainsi que des prostaglandines (dérivés de l’acide
arachidonique). Leur interaction permet de coordonner différentes fonctions de la reproduction : différenciation
sexuelle, croissance et développement, maturation sexuelles et production des gamètes.
GnRH (hypothalamus) dont les deux cibles hypophysaires sont la FSH et la LH.
Les stéroïdes : œstradiol (17-β- œstradiol = E2), testostérone et la progestérone (P4).
L’action des hormones peptidique est assez limité (acte sexuel) alors que les stéroïdes ont un spectre d’action très
large.
FECONDATION
PROCESSUS DE CAPACITATION
C’est l’ensemble des modifications biochimiques subit par le spermatozoïde pour qu’il puisse féconder l’ovocyte.
Libération d’enzyme lytique, déstabilisation de la membrane (réaction acrosomale).
CONCEPTION
L’expulsion du 2ème globule polaire fusion des deux noyaux zygote diploïde au bout de 30h.
La progestérone favorise la gestation mais inhibe la capacitation et induit la fermeture du col utérin pour empêcher
une deuxième fécondation. Les œstrogènes favorisent le déplacement de l’ovocyte dans l’oviducte.
DETERMINATION DU SEXE CHEZ LES MAMMIFERES
Deux étapes :
- détermination primaire = sexe génétique ne concerne que les gonades et ne dépend que des
chromosomes (/!\ les reptiles, la température d’incubation des œufs contrôle, le sex-ratio, n’est pas
uniquement dépendant les chromosomes).
- détermination secondaire : concerne tous les caractères phénotypiques autres que la gonade (tractus génital
et tous les caractères secondaires).
Avant 4 semaines, il est impossible de déterminer un phénotype sexuel car seul le sexe génétique est déterminé et
entre 4 et 8 semaines la gonade est indifférenciée ou bi-potentielle (mi-mâle, mi-femelle).
Au stade embryonnaire il coexiste les canaux de Muller (femelle) et de Wolf (mâles). Les canaux de Wolf
disparaissent pour donner une femelle et inversement.
Expériences de Jost (1953) : cela permet de voir l’importance des H chez le lapin
- Castration précoce bilatérale = seuls les canaux de Müller persistent → S'il n'y a plus de gonade, l'embryon
se développe spontanément vers le sexe phénotypique femelle.
- Castration unilatérale chez un mâle = du coté castré le canal de Müller se développe, et un peu Wolf. Et du
coté non castré, on a une régression du canal de Müller.
Au niveau testiculaire, il y a un facteur responsable de la régression d’un des 2 canaux.

Endocrinologie de la reproduction (Delaunay 2010-2011) Page 2
Si on effectue la même castration, mais plus tardive, on aura les 2 types de canaux qui se développent
partiellement.
- Il prend un embryon femelle et il lui greffe un testicule = régression du canal de Müller →
il fait l’hypothèse que cette H responsable de cette régression est la testostérone.
- On met un implant (cristal de testostérone) : développement des canaux de Wolf mais
pas régression de Müller → Ce n’est pas seulement la testostérone qui induit la
régression des canaux de Müller.
Le testicule est donc important pour la régression des canaux Muller et le maintient
de la différenciation chez les mâles.
Il y a des séries de syndromes de différentiation sexuelle dues aux anomalies génétique.
LE GENE SRY ET SON DOMAINE HMG
La détermination du sexe gonadique dépend de la présence du gène SRY. Chez
les mâles, la protéine TDF issue de l'expression de SRY possède un domaine
HMG (High Mobility Group ; 80aa, domaine très conservé), permettant à cette
protéine de se fixer sur l'ADN. Sa fixation sur l'ADN induit une courbure de
celui-ci de 70° à 80°. Cette courbure de l'ADN, aurait pour conséquence de
permettre le rapprochement et l'interaction des facteurs de transcription
contrôlant la différenciation des gonades. Ceci permettrait donc de déclencher
l'expression de gènes menant à la formation du testicule, et des autres
structures génitales masculines.
EST-CE QUE SRY EST NECESSAIRE ET SUFFISANT POUR CONTROLER LA DIFFERENCIATION SEXUELLE
MALE CHEZ LES MAMMIFERES ?
- création de souris XX transgénique avec le locus SRY
- croisement avec une souris WT (recombinaison hétérologue
donc le transgène est n’importe où)
SRY régule l’expression de gènes en se fixant sur les séquences
AACAAG qui sont retrouvés dans le gène Cyp19 (ou p450
aromatase). Elle aromatise la testostérone en œstradiol. SRY va
réprimer l’aromatase et favorise alors la différenciation du tractus
génital mâle.
SRY a un autre point de contrôle : le facteur de
transcription SRY reconnait un élément de réponse
dans le gène AMH (Anti Mulleriar Hormone) va avoir
une activité négative sur les canaux de Muller en stimulant l’apoptose. Ce facteur de transcription fait
partie de la même famille que TGF et TFG.
« SEXE DU CERVEAU » :
Sexe de l’hypothalamus (différenciation sexuelle du cerveau) : chez les femelles, la sécrétion des gonadotropines
(SH, LH) est cyclique alors qu’elle est continue chez le mâle. Ces cycles sont programmés très tôt, une fenêtre de 48h
après la naissance durant laquelle l’hypothalamus est programmé pour déclencher un pattern spécifique du sexe.

Endocrinologie de la reproduction (Delaunay 2010-2011) Page 3
LA MATURATION SEXUELLE = PUBERTE
Ensemble des modifications anatomiques et physiologiques qui vont permettre à un individu de passer d’un stade
sexuellement immature à un stade lui permettant de se reproduire.
Le développement de l’organisme est synchronisé avec le développement du système reproducteur. Différent de
l’hétérochronie (modification de la vitesse/durée de développement de l’organisme) chez l’Ambystome
(amphibien) : ils arrivent à se reproduire alors qu’ils sont encore au stade larvaire.
AVANT LA NAISSANCE :
Au cours de la grossesse, le taux d’œstrogènes ↗ ce qui va
provoquer un feedback négatif sur l’hypothalamus = ↘ GnRH = ↘
LH et FSH qui sont donc en concentration très basse ([œstrogène] la
plus élevée) à cause de la barrière placentaire pic de LH et FSH à
la naissance. Jusqu’au début de la puberté, on observe des pics
épisodiques.
ENTRE 9 ET 14 ANS :
La puberté correspond à la mise en place des profils d’expression
des hormones, s’installe un rythme cyclique (amplitude et
fréquence) et pulsatile.
A maturité, le GnRH va être sécrété de manière pulsatile avec une
fréquence de 90 à 120 minutes.
Chez le mâle, la sécrétion de GnRH induit un même type de
sécrétion de LH et de testostérone.
Chez la femme, à l’approche de la puberté, on a un FB - exercé par
les œstrogènes et la testostérone est moins importante. Il faudra +
de stéroïdes sexuel pour obtenir le même effet de FB. On verra
progressivement augmenter les concentrations en FSH et LH.
Sécrétion + importante de FSH chez les femelles que chez les mâles.
Les stéroïdes sexuels voient leur sécrétion augmenter, vont circuler associé à des protéines de transport SHBG (Sex
Hormone Binding Globuline); rôle important car elle contrôle l’activité biologique
La testostérone régule négativement la SHBG tandis que l’œstradiol la stimule.
[testostérone] totale : femelle < (x20) mâle.
[testostérone] libre : femelle < (x40) mâle.
L’AXE GONADIQUE FEMELLE
MISE EN PLACE DU CYCLE OVARIEN
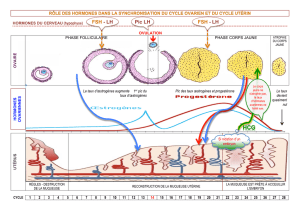
Mise en place d’une inversion du FB – en FB + des œstrogènes sur l’axe HT-HP au moment de l’ovulation.
Pratiquement pas d’ovulation pendant la première année de la puberté, et il faut au moins 5 ans pour obtenir une
ovulation dans 80% des cycles.
Les Androgènes surrénaliens sont d’excellents marqueurs de puberté et de vieillissement.
Le DHEA est un androgène à faible activité androgénique (précurseur d’œstrogènes) → On dose sa forme sulfatée
(DHEAs) qui est un intermédiaire dans la synthèse des androgènes
Age
[DHEA-S] µM chez la femelle
[DHEA-S] µM chez le mâle
1-6
0,5
0,9
8-10
2
4
12-14
4,6
5,8
16-20
9,1
8

Endocrinologie de la reproduction (Delaunay 2010-2011) Page 4
L’AXE HYPOTHALAMO-HYPOPHYSAIRE
Le noyau arqué dans l’hypothalamus sécrète la GnRH (décapeptide) de façon pulsatile qui agit sur l’hypophyse
antérieure, en particulier les cellules gonatotropes ce qui stimule la synthèse et la sécrétion de LH et FSH.
Pour mettre en évidence la fonction de ces structures, on pratique une ablation/lésion = supprime la sécrétion de LH
et FSH.
La FSH est une glycoprotéine hétérodimérique, les chaines et sont codés par des gènes différents :
- confère la spécificité lié à l’espèce (la chaîne a de FSH et LH sont les mêmes)
- confère la spécificité hormonale
La synthèse de la sous-unité est constante tandis que celle de est limitante (régulée).
Rôle de la FSH : stimule la prolifération et la différenciation des cellules de la granulosa. Elle fait partie de la classe
des H peptidiques, son récepteur est donc membranaire.
La LH est produite par les cellules gonadotropes (comme FSH). Les œstrogènes stimulent la production hypophysaire
de LH en augmentant la sensibilité des gonadotropes au GnRH. La LH est le régulateur majeur de la production de
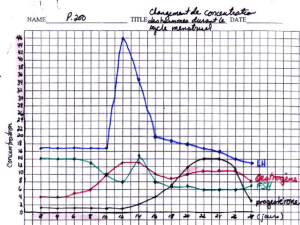
stéroïdes (=stéroïogenèse) : œstrogène, progestérone, testostérone. On remarque Sécrétion pulsatile des hormones
hypothalamique. Les pics de LH sont synchrones avec les pics de GnRH. La [LH] est en ng/ml et [GnRH] en pg/ml.
L’OVAIRE
Double fonction :
- Exocrine : assure la maturation et l’émission cyclique des ovocytes
- Endocrine : synthèse et sécrétion d’hormones nécessaire à l’ovulation, le développement du fœtus, la
lactation, l’implantation de l’ovocyte fécondé et le rétrocontrôle de l’axe HT-HP.
Anatomie : - une zone externe : le cortex,
- une zone interne : la médulla
Sous le tissu conjonctif, on a un épithélium germinal qui donne des cellules germinales, les oogonies. Ces cellules se
multiplient pendant la vie fœtale.
Nombre de cellules germinales en fonction de l’âge : 7 millions
à 6 mois, 400 000 oogonies quand les ovaires fonctionnent (13
ans) et seulement 400 cellules vont maturer, soit 99% vont
devenir atrésiques (atrésie = diminution ou l'atrophie de
follicules dans tout stade et à n'importe quel moment de la vie
d'une femme).
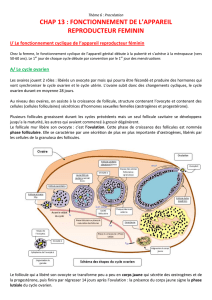
Chez les mammifères, il existe 2 types de cycle ovarien:
- œstral : ovulation en début de cycle (chez les souris)
- menstruel (ovarien) : ovulation en milieu de cycle.
Le cycle ovarien comprend 4 phases : voir ci-contre.
phase menstruelle
= transition utéo-
folliculaire
phase
folliculaire
(14j)
ovulation (48h)
= transition utéo-
folliculo-lutéale
phase lutéale
(12 à 16j)

Endocrinologie de la reproduction (Delaunay 2010-2011) Page 5
LA FOLLICULOGENESE
Processus par lequel le follicule primordial va croître et maturer pour aboutir à l’ovulation d’un ou plusieurs ovocytes
aptes à la fécondation. Ce processus est long (+ long que le cycle ovarien). Les follicules se développent par cohorte
en parallèle. Un follicule va être sélectionné pour l’ovulation d’où l’importance du niveau d’expression du récepteur
à la LH.
Au cours de son développement, le follicule passe par plusieurs stades:
1. Recrutement
Dès que la cellule reproductrice (ovocyte) entame sa croissance, elle s'entoure d'une couche de cellules aplaties
disposées en couronne, séparée de l'ovaire proprement dit par une membrane. On parle de follicule primordial qui
mesure environ 0,05mm de diamètre.
2. Croissance folliculaire basale :
Les cellules de la couche périphérique vont proliférer et prendre un aspect cubique. Ce sont les follicules primaires,
à peine plus gros.
La prolifération des cellules se poursuit, et celles-ci s'organisent en plusieurs couches concentriques, dont la plus
interne formera la zone pellucide de l'ovule, et les plus externes, la corona radiata.
Ce sont les follicules secondaires mesurant 0,2mm environ.
Ces 3 types de follicules forment la catégorie des follicules pré-antraux qui, pour la plupart, en dehors de l'influence
hormonale des cycles ovariens, dégénèreront.
3. Phase de croissance du follicule terminale
Dès le début de la phase folliculaire du cycle ovarien, sous l'influence de la FSH, quelques follicules pré-antraux (0,5 à
5mm de diamètre) vont poursuivre leur développement. Leurs cellules vont sécréter un liquide qui va creuser une
cavité dans le follicule: l'antrum.
L'ovocyte se trouve à présent refoulé sur le côté du follicule.
Dans un cycle normal, non stimulé, une sélection s'opère dès le 5e jour du cycle (suite à l'augmentation des
oestrogènes), et seul le follicule le plus sensible va poursuivre son développement. Ce follicule est le seul qui
atteindra la maturation et fera l'objet d'une ovulation. C'est le follicule de De Graaf (15 à 30mm).
Vers le 14e jour d'un cycle idéal de 28 jours, environ 36 à 48h après le début du pic de LH, l'ovocyte va se détacher
de la paroi du follicule et être relâché ovulation
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%