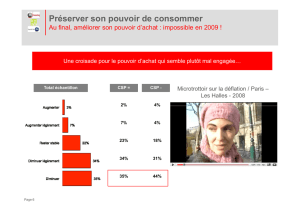
TP -‐COURS 1STD2A TP M 01 C IV. a) Définition Une réaction d

TP#$COURS#
1STD2A#
THÈME#MONDE#DE#LA#MATIERE#/#MONDE#OBJET#
CH.#III#RÉACTIONS#CHIMIQUES#ENTRE#UN#MÉTAL#ET#UN#ION#
RÉACTIONS#D’OXYDORÉDUCTION!
TP#M#01#C#
PAGE#1#/#7#
IV. RÉACTION#D’OXYDO#RÉDUCTION#
a) Définition#
Une réaction d’oxydoréduction met en jeu un transfert d’électrons entre deux espèces chimique
appartenant à deux couples d’oxydoréduction. #
Ox1 /Red1 et Ox2/Red2
Demi équations électroniques
Ox1/Red1 : Ox1 + n1e- Red1
Ox2/Red2 : Ox2 + n2e–Red2
L’oxydant Ox1 d’un couple oxyde le réducteur Red2 d’un autre couple
Les demi équations s’écrivent alors (on inverse l’écriture du couple de l’espèce réductrice)
Ox1/Red1 : Ox1 + n1e- Red1 (a)
Ox2/Red2 : Red2 Ox2 + n2e– (b)
b) Écriture d’une équation d’oxydo-réduction
À retenir
Le nombre d’électron échangé par l’espèce oxydante et l’espèce réductrice doit être le même
Il faut alors multiplier les deux demi équations électroniques par des coefficients afin de faire apparaître
un nombre identique d’électrons échangés
Exemple :
On sait que l’ion argent Ag+ oxyde le cuivre métallique Cu pour donner des atomes d’argent
1/ Inventorier les couples mis en jeu et demi équations électroniques correspondantes
Couples mis en jeu
Ag+ /Ag : demi équation pour l’espèce oxydante : Ag+ +e - Ag (a)
Cu2+ /Cu : demi équation pour l’espèce réductrice : Cu Cu2+ + 2e– (b)
2/ Multiplier les deux membres de chaque équation afin que le nombre d’électrons échangés
soit le même
(a)×2##2#Ag+ + 2 e - !2!Ag
(b)×1# Cu Cu2+ + 2e–
3/#Ajouter#membre#à#membre#les#deux#demi#équations#en#tenant#compte#des#coefficients#
multiplicatifs#
(a)×2#+#(b)×1#
2#Ag+ + Cu + 2 e - !2!Ag + Cu2++2e–
4/##Supprimer#les#électrons#qui#doivent#apparaître#en#même#nombre#dans#les#deux#
membres#de#l’équation#
#
2#Ag+ + Cu !2!Ag + Cu2+
c) Exercices
L’ion cuivre Cu2+ oxyde l’aluminium métallique Al : écrire l’équation de la réaction d’oxydo-
réduction correspondante, dire qui est l’oxydant et qui est le réducteur
On donne les couples d’oxydo-réduction correspondant Cu2+ /Cu et Al3+ /Al
........................................................................................................................................................
........................................................................................................................................................
........................................................................................................................................................
........................................................................................................................................................
........................................................................................................................................................
........................................................................................................................................................
#

V. CLASSIFICATION!!QUALITATIVE##DES##COUPLES##REDOX.#
a) Comparaison des couples Cu2+ / Cu et Ag+ / Ag :
- Si on plonge un fil de cuivre dans une solution contenant des ions Ag+, le fil de cuivre se recouvre
d’argent : ……………
Il#y#a#une#réaction#spontanée#:#
2#Ag+ + Cu !2!Ag + Cu2+
- Mais si on plonge un fil d'argent dans une solution contenant des ions Cu2+, il ne se passe rien :
il n’y a pas de réaction spontanée
Ag + Cu2+ rien
On constate donc que :
- les ions Ag+ ………………….. le métal Cu mais les ions Cu2+
n’oxydent pas le métal Ag :
on dit que les ions Ag+ sont plus …………………… que les ions
Cu2+.
- le métal Cu ………………. les ions Ag+ mais le métal Ag ne
réduit pas les ions Cu2+ :
on dit que le métal Cu est plus ………………………... que le
métal Ag.
b) Classification des couples
On traduit cela en classant les 2 couples sur un axe vertical, les
oxydants à gauche et les réducteurs à droite. (voir ci contre)
Une! méthode! permettant! de! trouver! rapidement! cette! réaction!
spontanée!est!la!règle!du!gamma!:!
La! branche! descendante! du! γ! relie! les! réactifs! tandis! que! la!
branche! ascendante! indique! les! produits! de! la! réaction!
spontanée!possible.!
!
#
! !

TP#$COURS#
1STD2A#
THÈME#MONDE#DE#LA#MATIERE#/#MONDE#OBJET#
CH.#IV#RÉACTIONS#D’OXYDORÉDUCTION#
ACTION#DES#ACIDES#SUR#LES#MÉTAUX!
TP#M#01#C#
PAGE#3#/#7#
I. ##OBJECTIFS. #
Les acides peuvent-ils avoir une action sur les métaux ? On se propose d’étudier l’action de l’acide chlorhydrique sur
différents métaux. Les réactions chimiques, lorsqu’elles ont lieu, sont des réactions d’oxydoréduction.
Quels sont alors les couples redox mis en jeu?
I. ##RAPPELS#SUR#LES#SOLUTIONS#ACIDES.#
On sait qu’une solution acide (dont le pH est …… à 7) contient des (ions hydronium) …………. en grande quantité.
L’ion H3O+ (aq) étant simplement un ion hydrogène …… hydraté (H+ + H2O ………), pour simplifier,
on notera les formules des solutions acides en utilisant H+ (aq):
- solution d'acide chlorhydrique …………………..
- solution d'acide sulfurique …………………..
#
II. ###EXPÉRIENCE#1#:#ACTION#DE#L’ACIDE#CHLORHYDRIQUE#SUR#LE#ZINC#
Dans un tube à essais, introduisez quelques grenailles de
zinc puis verser environ 1 mL d’acide chlorhydrique.
Faire un schéma légendé, indiquer les observations.
1- Quel est le gaz qui se forme ? Décrire l’expérience
permettant de mettre en évidence une caractéristique de
ce gaz ?
........................................................................................
........................................................................................
........................................................................................
2- Laisser le dégagement se poursuivre quelques minutes,
puis verser un peu de la solution dans un autre tube à
essais.
Dans ce tube, ajoutez-y une solution d’hydroxyde de
sodium goutte à goutte.
a) Qu’observe-t-on ?
........................................................................................
........................................................................................
........................................................................................
........................................................................................
b) Quelle est l’espèce chimique qui est caractérisée ici par
la solution d’hydroxyde de sodium ?
........................................................................................
........................................................................................
........................................................................................
c) Écrire l’équation bilan de cette réaction de précipitation.
........................................................................................
........................................................................................
........................................................................................
3- Interprétation de l’action de l’acide chlorhydrique sur le zinc. La solution d’acide chlorhydrique contient des ions
H+ et des ions Cl- Lors de l’action de l’acide, deux espèces chimiques se sont formées.
...........................................................................................................................................................................................
...........................................................................................................................................................................................
...........................................................................................................................................................................................
Écrire l’équation bilan de la réaction chimique entre le zinc et l’acide.
...........................................................................................................................................................................................
...........................................................................................................................................................................................
...........................................................................................................................................................................................
4- Identifier l’espèce chimique qui est l’oxydant et celle qui est oxydée (le réducteur) ?
...........................................................................................................................................................................................
...........................................................................................................................................................................................
5- Quels sont les couples d’oxydo-réduction mis en jeu ?
...........................................................................................................................................................................................
...........................................................................................................................................................................................

III. ###EXPÉRIENCE#2#:#ACTION#DE#L’ACIDE#CHLORHYDRIQUE#SUR#LE#FER#
Dans un tube à essais, introduisez une pointe de spatule de fer
en poudre puis verser environ 1 mL l’acide
chlorhydrique.
Faire un schéma légendé, indiquer les observations.
...................................................................................................
...................................................................................................
...................................................................................................
1-Quel est le gaz qui se forme ?
...................................................................................................
...................................................................................................
2-Laisser le dégagement se poursuivre quelques minutes, puis
verser un peu de la solution dans un tube à essais.
Dans ce tube, ajoutez-y une solution d’hydroxyde de sodium
goutte à goutte.
a) Qu’observe-t-on ?
...................................................................................................
...................................................................................................
b) Quelle espèce chimique est caractérisée par la solution
d’hydroxyde de sodium ?
...................................................................................................
...................................................................................................
...................................................................................................
c) Écrire l’équation bilan de cette réaction de précipitation.
...........................................................................................
...........................................................................................
...........................................................................................
IV. #EXPÉRIENCE#3#:#ACTION#DE#L’ACIDE#CHLORHYDRIQUE#SUR#LE#CUIVRE#
Dans un tube à essais, introduisez un copeau de cuivre puis
verser de l’acide chlorhydrique. Noter vos observations. Verser
un peu de la solution dans un tube à essais.
Dans ce tube, ajoutez-y une solution d’hydroxyde de sodium
goutte à goutte.
Faire un schéma légendé, indiquer les observations.
a) Qu’observe-t-on ?
...................................................................................................
...................................................................................................
...................................................................................................
b) Rédiger une conclusion. ................................................
...........................................................................................
...........................................................................................
c.
III. CONCLUSION :
Sur une classification électrochimique, on reportera les couples redox suivant Zn2+/Zn, Fe2+/Fe, Cu2+/Cu, H+/H2.
On utilisera une flèche vers le haut pour le pouvoir oxydant croissant et une flèche vers le bas pour le pouvoir
réducteur croissant.
! !

EXERCICES#
THÈME#MONDE#DE#LA#MATIERE#/#MONDE#OBJET#
CH.#III#RÉACTIONS#CHIMIQUES#ENTRE#UN#MÉTAL#ET#UN#ION#
RÉACTIONS#D’OXYDORÉDUCTION!
TP#M#01#C#
PAGE#5#/#7#
Exercice 1
Ajuster les équations suivantes qui traduisent des réactions d’oxydoréduction spontanées (on dit
aussi naturelles)
…Au3+ + …Al ###→!Au + Al3+
…Hg2+ + …Al ###→!…Hg +…Al3+
…Au3+ + …Hg ###→!…Au + …Hg 2+
a) Pour les équations 1 et 2, indiquer :
- l’oxydant, le réducteur
- les couples d’oxydoréduction concernés
- Les demi-équations électroniques mises en jeu
b) Classer les réducteurs et les oxydants respectivement par pouvoir réducteur et oxydant
croissants
c) Le cuivre est plus réducteur que le mercure Hg. L’ion Cu2+ est plus oxydant que l’ion Al3+
Indiquer la position relative des quatre couples d’oxydoréduction mis en jeu dans la
classification électrochimique qualitative (sur un axe vertical)
d) Y a-t-il réaction si on plonge une lame de cuivre dans une solution de chlorure d’or (Au3++ 3Cl–)
?
e) Et si on plonge une lame de cuivre dans une solution de sulfate d’aluminium (2Al3+ + 3SO4
2– ) ?
#
Exercice 2
Soit l’équation bilan non ajustée ci-dessous
Cr 2++ Al ###→!Cr + Al3+
a) Ajuster cette réaction
b) Identifier les couples d’oxydoréduction mis en jeu ; en déduire les demi-équations électroniques
correspondantes
Exercice 3
Dire si les affirmations ci-dessous sont exactes ou fausses. Justifier. Dans le cas ou l’affirmation est
exacte et qu’il y a réaction, écrire l’équation bilan.
Données :
Les couples suivants sont classés dans l’ordre des pouvoirs réducteurs croissants
Fe2+/Fe Sn2+/Sn H+/H2 Ag+ /Ag
1) De l’argent dans une solution de nitrate de fer II donne un dépôt de fer
2) Du fer dans une solution d’acide chlorhydrique donne un dégagement de dihydrogène
3) De l’étain dans une solution de chlorure de fer II donne un dépôt de fer
4) L’argent ne réagit pas avec l’acide chlorhydrique
5) De l’étain dans une solution de nitrate d’argent donne un dépôt d’argent!
!
!
!
!
!
 6
6
 7
7
1
/
7
100%