examen sur les cours d`electrochimie et de

INSTITUT UNIVERSITAIRE PROFESSIONALISÉ
GÉNIE DES SYSTÈMES INDUSTRIELS
UNIVERSITÉ
JOSEPH FOURIER
G R E N O B L E 1
UFR
DE CHIMIE
SCIENCES.
TECHNOLOGIE. MÉDECINE
Examen sur les cours d’Électrochimie
et de Corrosion
1ère Session (19/05/03)
________________________________________________________________________________
Durée 2h. Documents et calculatrices autorisés.
Le sujet d’examen comporte 4 pages. Barème : Ex.1 ≈ Ex. 2 ≈ Ex. 3 ≈ Ex. 4.
________________________________________________________________________________
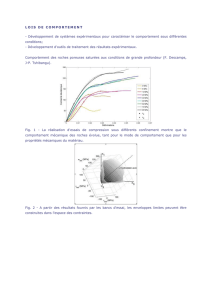
Exercice 1: Polarographie sur EDT de Pt
On désire mesurer la concentration d’une espèce R en solution en utilisant une électrode à disque tournant de Pt. Pour
cela on trace, en régime stationnaire, les courbes If vs. E du système redox O/R pour différentes concentrations
connues de l’espèce R avecO*=0. La surface de l’électrode est de S=1 cm2. La vitesse de rotation de l’électrode est
de 1000 tr mn–1. Le système redox met en jeu le transfert d’un seul électron.
-0.2 -0.1 0 0.1 0.2
EêHVêRefL
0
0.5
1
1.5
2
IfêmA
Fig. 1: Courbes If vs. E tracées pour différentes valeurs de la concentration en espèce R.
1.1. Expliquer la forme des courbes. Comment varie le palier limite avec la concentration en R au sein de la solution ?
Augmente-t-il ou diminue-t-il avec cette concentration ?
1.2. Les valeurs du courant mesurées sur les paliers limites d’oxydation sont: IdR/mA = 0.40, 0.80, 1.20, 1.60 et 2.00.
La Fig. 2 présente l’évolution de ce courant limite avec la concentration en R. Proposer une méthode graphique de
mesure, sans calcul, de la concentration en R d’une solution.
0 0.002 0.004
R
*
êHmol L
-1
L
0
0.5
1
1.5
2
I
dR
êmA
Fig. 2: Évolution du courant limite avec la concentration en espèceR.
UIP - GSI2 - Examen sur les cours d’Électrochimie et de Corrosion 2003 - 1 -

1.3. Pour une solution A de concentration inconnue en R on mesure, dans les mêmes conditions expérimentales de
température et de vitesse de rotation de l’électrode, un courant limite valant IdR = 3.5 mA. Montrer qu’il est possible en
effectuant une dilution de la solution inconnue de déterminer la concentration en R en utilisant la Fig. 2. Quelle est la
concentration en R de la solution A.
1.4. Pour une solution B de concentration inconnue en R on a mesuré un courant limite valant IdR = 3 mA, mais pour
une vitesse de rotation d’électrode, choisie par mégarde, de 4000 tr mn–1. Peut-on néanmoins en déduire la concentration
en R de la solution B ? Si oui quelle est cette concentration ?
1. 5. Le coefficient de diffusion de R est de DR = 5 10–6 cm2 s–1. Donner la valeur de la viscosité cinématique des
solutions utilisées pour tracer les courbes de la Fig. 1.
Exercice 2: Mesure de paramètres cinétiques
2.1. On étudie un système redox O + e ↔ R sur une électrode à disque tournant plongée dans un électrolyte désaéré
contenant les deux espèces O et R et un sel support. On trace la courbe log | | . Ivs
f
η
du système redox en régime
stationnaire (Fig. 2) pour deux vitesses de rotation d’électrode, l’une faible (courbe a) et l’autre élevée (courbe b).
-0.4 -0.2 0 0.2 0.4
hêV
-8
-6
-4
-2
0
log »I
f
êA»
a
-0.4 -0.2 0 0.2 0.4
hêV
-8
-6
-4
-2
0
log »I
f
êA»
b
Fig. 2: Graphes log | | . Ivs
f
η
obtenus pour deux vitesses de rotation de l’électrode. Courbe a: faible vitesse de
rotation, courbe b: forte vitesse de rotation. Représentation de Tafel.
Expliquer la différence entre les deux courbes.
On désire mesurer la valeur du courant d’échange du système redox, I0, et les valeurs des facteurs de symétrie
α
o et
α
r
de transfert électronique. Quelle courbe doit-on utiliser ? Déduire de cette courbe les valeurs de ces paramètres. Quelle
relation doit relier les deux facteurs de symétrie mesurés ? F = 96484 C mol–1. L’étude à été réalisée à 25°C.
2.2 Un expérimentateur distrait oublie d’ajouter du sel support et trace une courbe densité de courant vs. surtension
d’électrode dans les condition de la Fig. 2b. Les courbes obtenues avec et sans sel support sont comparées sur la Fig. 3.
On suppose que seule la valeur de la résistance de l’électrolyte varie lorsque l’on ne met pas de sel support.
UIP - GSI2 - Examen sur les cours d’Électrochimie et de Corrosion 2003 - 2 -

-0.4 -0.2 0 0.2 0.4
hêV
-8
-6
-4
-2
0
log »IfêA»
Fig. 3: Graphes log | | . Ivs
f
η
obtenus à forte vitesse de rotation de l’électrode avec sel support (trait fin) et sans
sel support (trait épais).
Discuter les conséquences de l’absence de sel support sur la détermination du courant d’échange et des facteurs de
symétrie. Que commettrait-on comme erreur en tentant néanmoins de déterminer les paramètres I0,
α
o et
α
r à partir
des résultats obtenus sans sel support ? Ces déterminations permettent-elles de suspecter la présence d’un problème de
mesure ?
Exercice 3: Métal passivable
E
0
i
f
MO
1
êR
1
O
2
êR
2
Fig. 4: Graphes if vs. E pour une électrode de métal M et deux couples redox O1/R1 et O2/R2.
3.1. Sur la Fig. 4 sont tracées les courbes if vs. E relatives au comportement électrochimique d’un métal et de deux
couples redox de potentiels thermodynamiques différents et caractérisés par des densités de courant d’échange et des
facteurs de symétrie égaux. Le métal M est mis dans une solution contenant le couple O1/R1 puis dans une seconde
solution contenant le couple O2/R2. Dans quelle solution le métal M se corrodera-t-il le plus vite ? Justifier votre
réponse, par exemple en traçant l’allure des courants totaux ii
fM fO R
+11/ et ii
fM fO R
+22/.
3.2. Certains métaux appelés métaux passivables présentent une courbe if vs. E en forme de cloche (Fig. 5).
UIP - GSI2 - Examen sur les cours d’Électrochimie et de Corrosion 2003 - 3 -

E
0
i
f
M
O
1
êR
1
E
0
i
f
MO
2
êR
2
Fig. 5: Graphes if vs. E pour une électrode de métal M passivable et deux couples redox O1/R1 et O2/R2. Les courbes
en pointillés sont les graphes des courbes −if vs. E des deux couples redox. Elles peuvent être utilisées pour
déterminer facilement la tension de corrosion du métal M.
Sur la Fig. 5 sont tracées les courbes if vs. E relatives au comportement électrochimique d’un métal passivable et de
deux couples redox de potentiels thermodynamiques différents et caractérisés par des densités de courant d’échange et des
facteurs de symétrie égaux. Le métal M est mis dans une solution contenant le couple O1/R1 puis dans une seconde
solution contenant le couple O2/R2. Dans quelle solution le métal M se corrodera-t-il le plus vite ? Justifier votre
réponse.
Exercice 4: Méthode de Stern et Geary
On rappelle que la relation if vs. E d’un métal dans un milieu où il se corrode s’écrit, lorsque les hypothèses de Stern
sont vérifiées:
i i nfEE nfEE
fcor o cor r cor
=−
()
−− −
()
()
exp ( exp (
αα
11 22
4.1. Rappeler les hypothèses de Stern. Donner l’expression de la dérivée di dE
f de la densité de courant par rapport à
E. di dE
f est l’inverse de la résistance de polarisation définie par:
RE di
dE
pf
()=1
4.2. Montrer que la résistance de polarisation s’écrit, à la tension de corrosion:
RE fn ni
p cor o r cor
()()
=+1
11 22
αα
4.3. En déduire une méthode de mesure de la densité du courant de corrosion utilisable lorsque l’on connaît les facteurs de
symétrie
α
o1,
α
r2 et les nombres d’électrons n1 et n2. Est-il nécessaire pour utiliser cette méthode de tracer la courbe
if vs. E sur une grande plage de tension autour de la tension de corrosion ?
UIP - GSI2 - Examen sur les cours d’Électrochimie et de Corrosion 2003 - 4 -
1
/
4
100%




![III - 1 - Structure de [2-NH2-5-Cl-C5H3NH]H2PO4](http://s1.studylibfr.com/store/data/001350928_1-6336ead36171de9b56ffcacd7d3acd1d-300x300.png)