BI202 – CHIMIE POUR BIOLOGIE 2 Travaux dirigés

1
LICENCE 1ère ANNEE
BI202 – CHIMIE POUR BIOLOGIE 2
Travaux dirigés
2014-2015

2
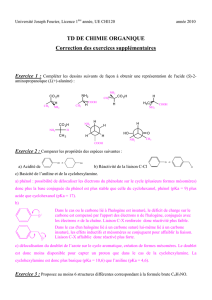
TD 1 : Nomenclature
Exercice 1
Pour les composés ci-dessous, donner la formule semi-développée et la forme bâton (écriture topologique) :
CH3(CH2)2CH3 CH3CH(OH)CH3 (CH3)2C(CH2CH3)2 (CH3)2C(OH)(CH2)2CH3
Exercice 2
Identifier les fonctions présentes dans les composés ci-dessous:
NH
O
Me
OH
Paracétamol
O O
OH
O
H3C
Aspirine
O
N
O
O
O
O
Cocaïne
Anisole
(anis)
SH
Gaz de la
mouffette rayée
O
Carvone
(essence de menthe)
CO2HH2N
SCH3
Méthionine
O
H
Hyacinthine
(parfum de jacinthe)
HO2C
H
N
O
OH
OH
Pantothénate
(constituant de la CoA)
OH
OO
Acide acétique Acétone
N
H
O
O
OH NH2
O
O
Aspartame
OH
Menthol
HO
OH
H
N
OH
Adrénaline
OH
O
OH NH2
O
Acide aspartique
O
NH2
NH2
OH
O
Glutamine

3
Exercice 3
a) Nommer les hydrocarbures ci-dessous en nomenclature systématique:
1- 2- 3- 4- 5-
6- 7- 8- 9- 10-
b) Dessiner une formule semi-développée ou simplifiée des molécules suivantes:
1) 2,3,4-triéthyl-1-phénylheptane 2) (4S,5R)-4-tertio-butyl-5-isopropyl-3,6-diméthylnonane
3) 1,1,4-triéthyl-2-benzyl-cyclohexane 4) 3,4-dipropylhexa-1,3-dièn-5-yne
5) 5-éthynylhepta-1,3,6-triène 6) p-éthylvinylbenzène
Exercice 4
Représentez la formule développée, semi-développée, la représentation de Cram et de Newman du propane.
Exercice 5
a) Nommer les composés halogénés ou amines ci-dessous en nomenclature systématique:
1-
Br
I
I
F
NH
NH2
NH2
Cl
N
2- 3- 4- 5- 6-
b) Dessiner une formule semi-développée ou simplifiée des molécules suivantes:
1) m-dichlorobenzène 2) N,N-diméthylallylamine
3) N,N-diméthylaminocyclopentane 4) N-éthyl-2-(4-bromophényl)éthylamine

4
TD 2 : Nomenclature et stéréochimie
Exercice 1
Soient les composés A, B et C suivants :
a- identifier les atomes de carbone hybridés sp3, sp2 et sp dans A
b- déterminer la formule brute de A et B,
c- identifier les fonctions.
Exercice 2
Nommer les composés dont les structures sont représentées dans les séries suivantes : identifier les
fonctions, les classer par ordre de priorité décroissante, déterminer la chaîne carbonée principale avant de
nomme le composé. Préciser la configuration des alcènes.
série 1 :
série 2 :
série 3 :
Exercice 3
Représenter la structure des composés suivants :
1-
2-(N-Méthylamino)-1-phényl propanol (éphédrine)
2-
4-Méthyl pent-3-ènol
3-
tert-Butyl-méthyl éther

5
4-
4-Amino-2-hydroxy-3-méthyl hexanal
5-
3, 3, 6-Triméthylhepta-1,5-dièn-4-one (cétone artémisia)
6-
Acide 4-amino-3-(4-chlorophényl)- butanoïque (baclofène)
7-
2-Méthyl- 3-oxo-butanoate d’éthyle,
8-
Bromure de 2-bromo-4-méthyl pentanoyle
9-
Anhydride benzoïque-butyrique
10-
N-Ethyl-2,2-diméthyl propanamide.
Exercice 4
Représenter l’acide (2S, 3S)-2-amino-3-hydoxybutanoïque :
1- selon Cram , fonction acide à droite de la chaîne,
2- selon Cram , fonction acide à gauche de la chaîne,
3- en perspective quand les liaisons C2-H et C3-H sont éclipsées,
4- selon Newman (axe C2-C3) dans la représentation du 1,
5-selon Fischer,
6- préciser si ce composé est de série D ou L ?
Exercice 5
Préciser la configuration des doubles liaisons des acides ricinoméique , columbinique et de C.
Dans le composé D, quel atome d’hydrogène Ha, Hb ou Hc faut-il remplacer par le groupe Méthyle pour
obtenir un alcène (Z) ?
Exercice 6
Identifier les carbones asymétriques dans les composés suivants ; préciser si les molécules sont chirales.
Préciser la configuration absolue des carbones chiraux des composés 3, 4 et 7.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%