Charge (en C)

activitésbis - 1 -
Lycée Français La
Pérouse
CH P4 La Radioactivité
TS Activités
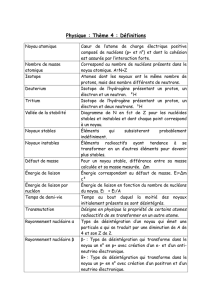
Activité 1 : Rappels sur les atomes
1. De quoi est constitué un atome ?
2. Le noyau d’un atome est représenté par A
ZX que représente chacune de ces lettres ?
3. Comment calculer N le nombre de neutrons dans le noyau ?
4. Remplir le tableau suivant :
Particule Masse (en kg) Charge (en C)
électron
proton
neutron
5. Qu’appelle-t-on noyaux isotopes ? donner des exemples.
6. Qu’appelle-t-on nucléides ? donner des exemples.
7. Quelles sont les interactions fondamentales agissant au sein de ce noyaux entre les nucléons? sont-elles attractives ou
répulsives ?
8. Donner l’ordre de grandeur de deux d’entre elles ( données : Rayon d’un nucléon R = 1fm ; on considérera que les protons
d’un noyau sont séparés par un nucléons) . Comment expliquer la cohésion d’un noyau ? ( Le fait qu’il n’ « explose » pas)
9. Que représente en physique la grandeur e ? en donner une définition. Quelle est son unité ?
10. Que savez vous pour toutes charges électriques q ?
Activité 2 : Découverte de la radioactivité. D’après le film « Les palmes de Monsieur Schultz »
Activité 3 : La radioactivité -
Le césium est un métal de la famille des alcalins :
11. Dans quelle colonne de la classification périodique se trouve- t- il ?
12. Utiliser la classification périodique pour déterminer le symbole du noyau de césium 137. Quelle est sa composition ?
13. Ce type de noyau est instable : il peut se désintégrer en donnant un noyau de baryum 137 et une particule appelée -. Le
noyau de césium est appelé noyau père, il donne naissance au noyau de baryum qui est le noyau fils .Utiliser la
classification périodique pour déterminer le symbole du noyau de baryum 137. Quelle est sa composition ?
14. Au cours d’une réaction nucléaire il y a conservation du nombre A de nucléons et conservation de la charge
électrique Z. Quel est le nombre de nucléons contenus dans la particule émise ? Quelle est sa charge ?
15. Quelle particule reconnaît-on ? Trouver son écriture en physique nucléaire (faire apparaître son nombre de nucléons en haut,
à gauche de son symbole et sa charge en bas à gauche)
16. Ecrire l’équation de la réaction nucléaire correspondante (du type BaCs 137
....
137
.... ……. )
17. D’après la composition des noyaux pères et fils, que s’est il passé ?
18. On note p
1
1 le symbole du proton en physique nucléaire et n
1
0celui du neutron. Donner par une équation nucléaire la
transformation observée par le neutron.
19. Bilan d’une désintégration - : écrire la réaction nucléaire générale d’un noyau père X
A
Zdonnant un noyau fils Y.
Activité 4 : La radioactivité +
Exemple : le noyau de Thallium 201 (symbole chimique Tl) utilisé en scintigraphie médicale est instable : Il se transforme en un noyau de
mercure 201 (symbole Hg) avec émission d’une particule appelée +.
20. Donner la composition du noyau père et du noyau fils.
21. En appliquant les 2 lois de conservation précédentes, trouver le nombre de nucléons ainsi que la charge électrique contenus
dans la particule +.
22. Cette particule + est appelée positon. Elle possède une masse identique à celle de l’électron mais une charge opposée à
celui-ci, son symbole est aussi e. Donner son symbole en physique nucléaire.
23. Ecrire l’équation de cette réaction nucléaire
24. Quelle est la particule qui s’est transformée ? Ecrire l’équation de la réaction nucléaire associée à cette transformation.
25. Bilan d’une désintégration + : écrire la réaction nucléaire générale d’un noyau père X
A
Z
Activité 5 : La radioactivité
Exemple : le noyau d’uranium 238 est émetteur d’une particule en donnant un noyau de Thorium 234 (Th).
26. Donner la composition du noyau père et du noyau fils.
27. En appliquant les 2 lois de conservation précédentes, trouver le nombre de nucléons contenus dans la particule et sa charge
électrique.
28. Cette particule est un noyau d’atome. Lequel (justifier) ? En déduire son symbole en physique nucléaire.
29. Ecrire l’équation de cette réaction nucléaire
30. Bilan d’une désintégration : écrire la réaction nucléaire générale d’un noyau père X
A
Z

activitésbis - 2 -
Correction
Activité 1 :
1. de nucléons( protons+ neutrons) et d’électrons
2. A : nombre de nucléons ou nombre de masse ; Z : nombre de protons ou nombre de charge ; X : symbole de l’élément
3. N = A-Z
4. Particule Masse (en kg) Charge (en C)
électron 9,109
10-31 kg -e = -1,60218910 -19 C
proton 1,67265
10-27 kg +e = +1,60218910 -19 C
neutron 1,67496
10-27 kg 0 C
5. Les noyaux sont appelés isotopes, s’ils ont le même nombre de charge (Z) mais un nombre de masse (A) différent. Les isotopes
d’un même élément ne différent donc que par leur nombre de neutrons.
Exemples : Les trois isotopes les plus connus de l'élément carbone sont :
Remarque : Aux 92 éléments qui existent sur Terre à l'état naturel correspondent 350 noyaux différents (290 sont stables, 60 sont
radioactifs). Aux 112 éléments que l'on connaît dans les laboratoires de physique nucléaire correspondent plus de 3000 noyaux différents.
6. Les nucléides : ensemble des noyaux ayant même A et même Z. exemple : Al et Al3+
7. Interaction gravitationnelle due aux masses des nucléons attractive, interaction électrique due aux charges répulsives, interaction
forte attractive
8. Interaction gravitationnelle = 10-35N ; interaction électrique : 10-1 N. L’interaction forte assure la cohésion du noyau des atomes.
9. e est appelé la charge élémentaire. Sa définition : Le proton et l’électron ont la même charge électrique en valeur absolue.
Comme l’électron est indivisible, une charge électrique élémentaire notée e est définie telle que : | e | = 1,60218910 -19 C.
10. Elles sont le multiple de la charge élémentaire e. q = n. | e |
12 13 14
666
C , C , C
1
/
2
100%