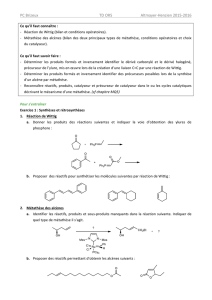
DM N°1 bis : Synthèse organique d`un inhibiteur enzymatique (D

!"#$%&'()*#+,#-./#0&1#23/4523/6#
!
!
1/7!
!"# $%&# '()#*# +,-./0)1# 2345-(671# 897-# (-/('(.173# 1-:,;5.(671# <!"#$%&'( )*+,'-
./+0'(1223(.45(
#
=1;53671#>3?@(;(-5(31#*#@1#)7A1.#5#?.?#@?4031;1-.#;28(B(?#1.#81)#5--1C1)#2-.#?.?#5A27.?1)#>273#
>27D2(3#.35(.13#7-#;5C(;7;#81#671).(2-)#)5-)#671#@1#E273)#E2331)>2-85-.#5(.#?.?#1-E231#.35(.?F#
#
La# Sphingofungine# F# est# un# inhibiteur# de# l’enzyme# Serinepalmitolyl# transferase#qui# joue# un# rôle# essentiel#
dans# la# biosynthèse# des# sphingolipides# précurseurs# des# céramides# de# la# peau# qui# restructurent# la# couche#
cornée# comme# un# ciment# et# stimulent# la# fabrication# naturelle# des# lipides.# La# Sphingofungine# F# dont# la#
structure#est#précisée#ci@dessous#est#un#dérivé#α@substitué#de#l’alanine.#Une#synthèse#stéréosélective#à#partir#
de#l’acide#tartrique#en#a#été#récemment#publiée#(G.Q.#Lin#et#coll.,#J.#Org.# Chem.#1222,# 65,# 9114)# ;#elle# est#
basée#sur#une#réaction#de#Wittig#entre#les#deux#fragments#[C1@C6]#et#[C7@C20].#
#
#
#
+>/(-42B7-4(-1#G#
# H#7#8#"95"23:# # # I#7#8"/5"6:#
########
Les# deux# séquences# réactionnelles# suivantes# (*+67$,+6#+0,')# décrivent# la# synthèse# préliminaire# des# deux#
précurseurs#de#8#(un#époxyaldéhyde)#et#9#(un#alcool#primaire)#correspondant#respectivement#aux#fragments#
[C1@C6]#et#[C7@C20].#
#
J#K#+,-./0)1#87#>3?E73)173#81#I#
#
Cette#synthèse#est#effectuée#à#partir#du#(+)@tartrate#de#diéthyle#4#énantiomériquement#pur#:#
#
&K ;)(#1&<=&>&(#?#1@=ABC1(#1AD%DE1DF(GA&H(#I#J#
#
LK +E==(%# FK# GE=>&<)%KA&E=# K01EF)(# L(1# GK%0E=(1# K1@MDA%&N)(1# L(# FK# MEFDG)F(# MO# "EM0&(=# (*&1A(5A5&F# L(#
1AD%DE&1EMC%(1# L(# GE=>&<)%KA&E=# L(# M#J# P(1# %(Q%D1(=A(%# R# FSK&L(# L(# FK# %(Q%D1(=AKA&E=# L(# "%KM# (A#
Q%DG&1(%#F(1#%(FKA&E=1#L(#1AD%DEGB&M&(#N)&#F(1#F&(=AO#
#
4#est# mis# en# présence# d’acétone# avec# une# catalyse# acide# réalisée# par# l’acide# paratoluènesulfonique# (noté#
TsOH),#on#obtient#alors#le#composé#!.#
#
NK ;)(F#(1A#F(#=EM#L(#G(AA(#%DKGA&E=#J#;)(F#(1A#a#priori#1E=#&=AD%TA#J#;)(F1#1E=A#F(1#KHK=AK<(1#L(#U1VW#QK%#
%KQQE%A# R# W"F#J# !%DG&1(%# F(# MDGK=&1M(# L(# G(AA(# %DKGA&E=# (A# LE==(%# )=(# %(Q%D1(=AKA&E=# LDH(FEQQD(#
1QKA&KF(#L(#!O#
#
O
OH
HO
OH
H2NCH3
O
OH
O
EtO
OH
O
OEt
OH
C

!"#$%&'()*#+,#-./#0&1#23/4523/6#
!
!
2/7!
!#est#traité#par#du#tetrahydruroaluminate#de#lithium#en#excès#pour#conduire#au#composé#:.#Cette#réaction#
permet#de#réduire#les#fonctions#ester#en#fonction#alcool.##
#
OK +E==(%# FK# >E%M)F(# LDH(FEQQD(# L(# PO# X=# GE=1&LD%K=A# P&YFWZ#GEMM(# )=# LE==()%# LS&E=1# B@L%)%(1# W[\#
Q%EQE1(%#)=#MDGK=&1M(#QE)%#G(AA(#%DKGA&E=#;<+6*=,(70#+0(6/++7(>?,(@,(A7=#+*'A,(+"#($#'(,+=/%,(707(
B?(,+(=/?%'(C(@,(D%/?$,A,+0(-E:0(,'0(?+(F/+(D%/?$,($#%0#+0G(*@($,?0(6/+=(',($%/6?*%,(?+,(#66*0*/+(
+?=@7/$H*@,('?*B*,(6"?+,(7@*A*+#0*/+5I#
#
QK "EMM(=A#Q()A5E=#QK11(%#L(#P#R#FK#MEFDG)F(#G#%(Q%D1(=AD(#G&5L(11E)1#J#
#
#
#
La# fonction# alcool# de# J#est# ensuite# oxydée# pour# obtenir# K#selon# une# oxydation# de# Swern.# Il# s’agit# d’une#
oxydation# douce# des# alcools# primaires# et# secondaires# respectivement# en# aldéhyde# et# en# cétone# dans# un#
milieu#contenant#du#chlorure#d’oxalyle#dans#le#DMSO#(diméthylsulfoxyde)#et#de#la#triéthylamine.##
#
RK "&A(%#)=#K)A%(#%DKGA&>#QE11&0F(#QE)%#G(AA(#E*@LKA&E=O#](Q%D1(=A(%#SO#
#
Le#composé#K#est#ensuite#dissous#dans#le#dichlorométhane#à#0#°C#puis#opposé#au#composé#L#ci@dessous#pour#
conduire#à#la#molécule#M#obtenue#majoritairement##avec#une#configuration#E.#M#est#alors#traité#par#LiAlH4#qui#
donne#le#composé#<.#
#
#
TK !%EQE1(%# )=(# 1@=ABC1(# L(# U#R# QK%A&%# L(# FSKG&L(# 250%EMEQ%EQK=E^N)(O#;.#'( ,+=/%,( B?( ,+( =/?%'($/?%(
@",'0,%(A#*'(N#(+,('#?%#*0(0#%6,%III5#
#
VK "EMM(=A#KQQ(FF(5A5E=#FK#%DKGA&E=#M(=K=A#R#W#J##I#@95(81#81#@95--1C1#&X#%(Q%D1(=A(%#FK#MEFDG)F(#WO##
#
YK ](Q%D1(=A(%#F(#Q%EL)&A#JO#
#
L’équipe# de# Sharpless,# prix# Nobel# de# chimie# 2001,# a# mis# au# point# une# technique# d’époxydation#
énantiosélective# des# alcènes,# utilisant# un# complexe# chiral# du# titane.# En# appliquant# cette# méthode# au#
composé# <#on# obtient# un# produit# O#dont# la# configuration# absolue# des# deux# nouveaux# atomes# de# carbone#
asymétriques#est#S.#
#
&ZK "&A(%#)=# %DKGA&>#GFK11&N)(#LSDQE*@LKA&E=#L(1# KFGC=(1O#;.#'( ,+=/%,( B?( ,+( =/?%'G( %7$/+',( 6/++7,( 6#+'(
@"#++,P,(15I#
#
&&K I#@95(81#81#@95--1C1#LX#%(Q%D1(=A(%#F(#Q%EL)&A#[O#
#
O#est#traité#par#le#tert@butylchlorodiméthylsilyle#(Q9!)R4@)#en#solution#dans#le#dichlorométhane,#en#présence#
d’imidazole.#Il#se#forme#alors#le#composé#S.#
#
#
OO
OOH
F
Ph3P
COOEt
Z
où Ph représente le groupe phényl -C6H5
Si
Cl
TBDMSCl : imidazole : NNH

!"#$%&'()*#+,#-./#0&1#23/4523/6#
!
!
3/7!
&LK ,E=A%(%#N)(#FS&M&LK'EF(#(1A#)=#KMQBEF@A(#(A#&L(=A&>&(%#F(1#GE)QF(1#KG&LE50K1&N)(1#GE%%(1QE=LK=A#K)*#
HKF()%1#L(#Q_K#L(#9\3#(A#/Z\4#`#a)1A&>&(%O#,E=A%(%#N)(#F(1#L()*#KAEM(1#LSK'EA(#1E=A#(=#>K&A#DN)&HKF(=A1O#
#
&NK Vb#1(#A%E)H(#F(#1&F&G&)M#LK=1#FK#GFK11&>&GKA&E=#QD%&EL&N)(#J#;)(F#(1A#F(#A@Q(#L(#%DKGA&E=#M&1(#(=#a()#LK=1#
FK#>E%MKA&E=#L)#GEMQE1D#\#J#](Q%D1(=A(%#\O#
#
Le# groupe# protecteur# –OBn# (Bn# =# benzyle)# est# ensuite# ôté# pour# rétablir# la# liaison# –OH,# ce# qui# donne# le#
composé# T#(C16H32O5Si).# Le# composé# T#est# alors# opposé# au# trioxyde# de# chrome# dans# la# pyridine# pour#
finalement#conduire#à#la#molécule#8.#On#obtient#un#composé#présentant#une#bande#vers#1720#cm−1#et#une#
bande#vers#2800#cm−1.#
#
&OK <IA27.#81#671).(2-]#!%EQE1(%#L(1#GE=L&A&E=1#EQD%KAE&%(1#QE)%#A%K=1>E%M(%#\#(=#^O#
#
&QK ](Q%D1(=A(%#IO#;)(F#(1A#FS&=AD%TA#L)#<%E)Q(#U$+,c#J#
#
#
JJ#K#+,-./0)1#87#>3?E73)173#81#H##
#
La#synthèse#de#l’intermédiaire#9#nécessite#l’intervention#du#6@iodohexan@1@ol.#Ce#dernier#est#transformé#en#
).#La#préparation#du#composé#)#fait#intervenir#la#réaction#entre#le#groupe#caractéristique#OH#d’un#alcool#et#
le#3,4@dihydro@2H@pyrane#(dont#le#nom#systématique#est#3@oxacyclohexène)#noté#DHP.#On#étudie#la#réaction#
modèle#entre#le#méthanol#et#le#DHP,#qui#conduit#à#la#formation#d’un#produit#d’addition#du#méthanol#sur#la#
double#liaison#du#DHP,#que#l’on#note#H3C@OTHP.#
#
#
#
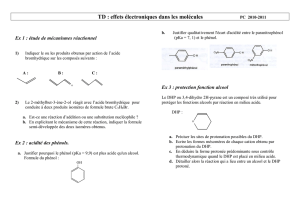
&RK +E==(%#FK#1A%)GA)%(#L(#FS(1QCG(#GKA&E=&N)(#MKaE%&AK&%(M(=A#E0A(=)(#N)K=L#F(#+W!#(1A#QFKGD#K)#GE=AKGA#
LS)=#M&F&()#KG&L(\#1&#FSDHEF)A&E=#L)#1@1ACM(#(1A#1E)1#GE=A%dF(#AB(%MEL@=KM&N)(O#
#
Par# action# du# méthanol# en# excès,# en# solution# dans# l’éthoxyéthane# anhydre# et# en# présence# d’acide# para@
toluènesulfonique,#le#DHP#est#transformé#en#un#composé(H3C@OTHP#de#formule#brute#C6H12O2.#
#
&TK !%EQE1(%#)=#MDGK=&1M(#QE)%#FK#>E%MKA&E=#L(#We"5VUW!O#
#
&VK PK#%DKGA&E=#f/g#GE=1A&A)(#)=(#DAKQ(#L(#Q%EA(GA&E=#L(#FK#>E=GA&E=#KFGEEFO#h)1A&>&(%#G(AA(#%(MK%N)(O#;)(F1#
1E=A#F(1#Q%EL)&A1#E0A(=)1#FE%1#L(#FK#LDQ%EA(GA&E=#J#
#
&YK "EM0&(=# L(# 1AD%DE&1EMC%(1# 1E=A# E0A(=)1# FE%1# L(# FK# %DKGA&E=# f/g# J# P(1# %(Q%D1(=A(%O#X=# N)(FF(1#
Q%EQE%A&E=1#F(1#A%E)H(5A5E=#J#h)1A&>&(%#F(#%K&1E==(M(=AO#
#
LZK X=#LDL)&%(#FK#1A%)GA)%(#L(#"O#
#
Le#composé#)#est#opposé#au#3@oxononanoate#de#méthyle#dans#un#mélange#DMF#(diméthylformamide)#et#
acétone# en# présence# de# K2CO3,# l’ensemble# est# porté# à# reflux# pour# obtenir# le# composé# U.# Ce# dernier# est#
ensuite# mis# à# reflux# dans# un# mélange# de# potasse# alcoolique# pour# former#E,# on# observe# un# dégagement#
gazeux#de#dioxyde#de#carbone.(;R0%?=0?%,(6,(E(6/++7,(=#%(@#(%7#=0*/+(+",'0($@?'(#?($%/D%#AA,5I#
#
H3COH +O
DHP
H
H3COTHP (Réaction (1))
THPO
O
O

!"#$%&'()*#+,#-./#0&1#23/4523/6#
!
!
4/7!
L&K I# @95(81# 81# @95--1C1# NX#LE==(%# FK# >E%M)F(# AEQEFE<&N)(# L(# $#(A# Q%EQE1(%# )=# MDGK=&1M(# QE)%# 1K#
>E%MKA&E=O#
#
E#est#ensuite#déprotégé#en#milieu#acide#pour#donner#9.#
#
L’analyse#RMN#du#composé#9#fournit#les#résultats#suivants#:#
Déplacement#chimique#du#spectre#RMN#du#proton#(dans#CDCl3,#300#MHz)#:##
#
#
LLK iL(=A&>&(%#F(1#L&>>D%(=A1#<%E)Q(1#L(#Q%EAE=1#1)%#FK#MEFDG)F(#HO#
#
#
JJJ#K#+,-./0)1#81#@5#+>/(-42B7-4(-1#G##
#
Le#composé#9#est#transformé#en#.#:##
#
#
LNK I#@95(81#81#@95--1C1#&X#Q%EQE1(%#)=#1GBDMK#L(#1@=ABC1(#Q(%M(AAK=A#LSE0A(=&%#_#R#QK%A&%#L(#HO#
#
.#est# ensuite# couplé# au# composé# 8#dans# du# THF# (tétrahydrofurane)# en# présence# de# nBuLi# à# –78°C.# On#
obtient#le#composé#V#dont#la#double#liaison#présente#une#configuration#Z.#
#
LOK I#@95(81#81#@95--1C1#&X#LE==(%#FK#1A%)GA)%(#L(#`O#
#
Par#une#suite#d’étapes#non#détaillées#ici,#on#transforme#enfin#le#composé#V#en#R$H*+D/W?+D*+,(JI(
#
#
aaaGJ$#!b#+b[Pcaaa#
# #
C6H13
PPh3
OO
Br
P
-.#
+DQFKG(M(=A#fQQMg#
&=AD<%KA&E=#
YFF)%(#L)#
1&<=KF#
"E)QFK<(#fW'g#
fKg#
3\j9#
e#W#
A#
9\3#
f0g#
/\265/\63#
/j#W#
M#
#
fGg#
2\e9#
Z#W#
A#
9\e#
fLg#
e\62#
2#W#
A#
6#

!"#$%&'()*#+,#-./#0&1#23/4523/6#
!
!
5/7!
I$$PdP+#
#
#
I--1C1#&#*#^5#3?5E.(2-#81#e(..(4#
PK#%DKGA&E=#L(#k&AA&<#(1A#FlKGA&E=#Ll)=#@F)%(#L(#QBE1QBE%(#1)%#)=#GEMQE1D#GK%0E=@FDO#
#
"(AA(# %DKGA&E=# (1A# (*A%TM(M(=A# )A&F&1D(# (=# 1@=ABC1(# GK%# (FF(# (1A# A%C1# 1DF(GA&H(\# (A# Q(%M(A# L(#
>E%M(%#)=#KFGC=(#L(#>KmE=#AEAKF(M(=A#GE=A%dFD(#fQK1#L(#%D<&E&1EMC%(#QE11&0F(#GE=A%K&%(M(=A#R#FK#
LD1B@L%KAKA&E=# Ll)=# KFGEEFgO# n(E%<# k&AA&<# K# %(m)# F(# Q%&*# -E0(F# L(# "B&M&(# (=# /o9o# QE)%# F(#
LDH(FEQQ(M(=A#L(#G(AA(#%DKGA&E=O#
#
f H(@5-#81#@5#3?5E.(2-#81#e(..(4#*(
#
PK# LE)0F(# F&K&1E=# !pV# DAK=A# A%C1# >E%A(\# FlE*@L(# L(# A%&QBD=@FQBE1QB&=(# (1A# A%C1# 1AK0F(\# LE=G# FK#
GE=1AK=A(#LlDN)&F&0%(#L(#FK#%DKGA&E=#(1A#DF(HD(O#PK#>E%MKA&E=#L(#FlE*@L(#L(#A%&QBD=@FQBE1QB&=(#(1A#
FK#>E%G(#MEA%&G(#L(#FK#%DKGA&E=O#
Exemple#:#
#
#
f _3?>535.(2-#81#@9,@731#81#>/2)>/231#*(
/C%(#DAKQ(#7#YGA&E=#L(#!!Be#1)%#)=#LD%&HD#BKFE<D=D#Q%&MK&%(#E)#1(GE=LK&%(#1(FE=#)=(#c-2#
#
2CM(#DAKQ(#7#YGA&E=#Ll)=(#0K1(#A%C1#>E%A(#f-W2
[\#W[\#$)P&\#OOOg#
#
#
# #
C P
R'
R
Ph
Ph
Ph
C P
R'
R
Ph
Ph
Ph
ylure de
phosphore
forme "ylène"
(moins représentative)
PPh3
R'
R
+O
R1
R2R'
R R1
R2
+Ph3P O
oxyde de
triphénylphosphine
Z et E
O+H2C PPh3+PPh3
O
Ph3P+R X
SN2
Ph3P R +X
sel de phosphonium
Ph3P R +
H
Bu Li BuH +LiX +Ph3P R
A/B
X +
ylure de
phosphore
 6
6
 7
7
1
/
7
100%