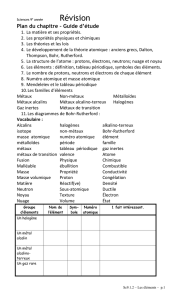
La structure atomique des éléments

La structure atomique des
éléments
Chapitre 2 Section 1

Les éléments…
•Les éléments consistent
d’un seul type d’atome.
Ex. Au – Or
O – Oxygène
Si – Silicium (Tin)
Hg – Mercure
Al – Aluminium
Pb – Plomb

Les éléments…
•Les éléments peuvent être métal ou
non-métal.
•Les éléments peuvent se combiner pour
former des composés ionique (en
général - métal et non-métal) ou
covalent (en général - non-métal et non-
métal)

Les éléments…
•Tous les éléments à
la gauche sont des
métaux et tous les
éléments à la droite
sont des non-
métaux.
•Ces éléments ont
des propriétés des
métaux et non-
métaux.

Les éléments
•Les métaux sont des
éléments durs,
brillants, malléables,
ductiles et bons
conducteurs de la
chaleur et de
l’électricité.
•Les non-métaux sont
des éléments qui ont
des propriétés
différentes par
exemple, gazeux ou
des solides fragiles à
la température
ambiante.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%


![Science 9 Chapter 2 notes [Compatibility Mode]](http://s1.studylibfr.com/store/data/004955198_1-035ca9f03747481c23ba73c4761c704f-300x300.png)