Exercices d'électrolyse & Solutions: Chimie Lycée

Chimie – Terminale S
Chapitre 7
Correction des exercices
1
Electrolyses : exercices (correction)
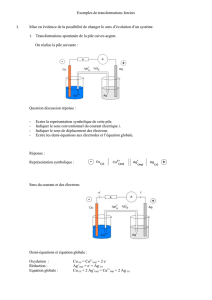
L’affinage du cuivre
Le cuivre obtenu à partir de son minerai contient habituellement beaucoup d’impuretés (du zinc, du fer,
de l’argent, de l’or…). Pour le raffiner, on réalise l’électrolyse d’une solution de sulfate de cuivre
acidifiée, en utilisant une cathode en cuivre pur. Cette technique permet d’obtenir du cuivre pur à 99,5 %
au moins.
1. Faire le schéma de l’électrolyse.
2. Indiquer toutes les oxydations possibles à l’anode.
A l’anode, a priori, tous les métaux réducteurs du minerai peuvent être oxydés,
Cu(s) = Cu2+(aq) + 2 e–
Zn(s) = Zn2+(aq) + 2 e–
Fe(s) = Fe2+(aq) + 2 e–
Ag(s) = Ag+(aq) + e–
Au(s) = Au3+(aq) + 3 e–
3. En réalité, seuls le cuivre, le zinc et le fer sont oxydés, mais les cations du fer et du zinc ne sont
pas réduits à la cathode ; on n’observe aucun dégagement gazeux à cette électrode.
Quelle est l’équation de la réaction correspondant à cette électrolyse ?
A l’anode, donc :
Cu(s) = Cu2+(aq) + 2 e–
Zn(s) = Zn2+(aq) + 2 e–
Fe(s) = Fe2+(aq) + 2 e–
A la cathode, seuls les ions cuivre(II) sont réduits,
Cu2+(aq) + 2 e– = Cu(s)
Au final, on peut écrire l’équation de l’électrolyse sous la forme
Cu2+(aq) + Cu(s)anode/minerai = Cu(s)cathode + Cu2+(aq)
4. De quoi sont composées les impuretés récupérées au fond de l’électrolyseur ? Conclure.
Le cuivre oxydé à l’anode provoquera certainement sa désagrégation ; parmi les impuretés qui se
déposeront au fond de l’électrolyseur, il y aura probablement un peu d’or et d’argent métalliques… qu’on
peut éventuellement récupérer à leur tour !
L’accumulateur nickel-cadmium
L’accumulateur nickel-cadmium est employé dans de nombreux appareils électriques autonomes. Il est
étanche et plus stable du point de vue chimique qu’une batterie d’accumulateurs au plomb. Il peut, en
outre, rester inemployé durant des périodes prolongées.
Couples rédox : NiO(OH)/Ni(OH)2 et Cd(OH)2/Cd solides ou gélifiés
G
Cu
2+
(aq) + SO4
2
–
(aq)
Cuivre Cu(s) pur
CATHODE
Minerai impur
ANODE
+
i

Chimie – Terminale S
Chapitre 7
Correction des exercices
2
1. Ecrire les demi-équations électroniques correspondant à ces deux couples.
NiO(OH) + H+ + e– = Ni(OH)2
Cd(OH)2 + 2H+ + 2 e– = Cd + 2 H2O
2. Sachant que du cadmium est reformé durant la charge de cet accumulateur, indiquer les réactions
qui ont lieu au niveau des électrodes.
Lors de la charge, si Cd(OH)2 est réduit pour former Cd à la cathode,
Cd(OH)2 + 2H+ + 2 e– = Cd + 2 H2O
alors Ni(OH)2 est oxydé à l’anode,
Ni(OH)2 = NiO(OH) + H+ + e–
3. En déduire les équations des réactions lors de la charge, et lors de la décharge.
Lors de la charge,
Cd(OH)2 + 2 Ni(OH)2 = Cd + 2 H2O + 2 NiO(OH)
Lors de la décharge, la réaction est inverse :
Cd + 2 H2O + 2 NiO(OH) = Cd(OH)2 + 2 Ni(OH)2
4. Indiquer la polarité de cet « accu » au cours de sa décharge.
Lors de la décharge, le couple lié au cadmium est oxydé et perd des électrons ; il constitue donc la borne
négative de cet accumulateur, le couple lié au nickel (hydroxyde de nickel) en constituant le pôle positif.
Chromage d’une pièce métallique
Pour chromer une pièce métallique de 20 cm², on réalise l’électrolyse d’une solution contenant des ions
chrome Cr3+(aq). On veut déposer une couche de chrome de 50 µm d’épaisseur.
1. La pièce métallique sert d’électrode dans cette électrolyse. Doit-elle être la cathode ou l’anode ?
Justifier.
Au niveau de cette pièce métallique doit se produire la réduction des ions Cr3+(aq) en métal Cr(s) : elle
doit donc être la cathode.
2. Calculer la masse de chrome à déposer sur la pièce métallique.
4 6
7, 200 20.10 50.10 0,72
Cr Cr Cr Cr
m V S e g
Attention : la densité donnée correspond à une masse volumique en kg/m3!
3. En déduire la quantité de matière correspondante.
2
0,72 1, 4.10
52
Cr
Cr
Cr
m
n mol
M
4. Quelle doit être l’intensité du courant (supposée constante) pour que l’opération se fasse en 10
heures ?
Equation de réduction : 3
( ) 3 ( )
Cr aq e Cr s
La formation d’un atome de chrome s’accompagne de la disparition de 3 électrons. Ainsi,
3Cr
n e n
Q
I
t t t
F
F
A.N. :
2
3 1, 4.10 96500
0,11
10 3600
I A
Pile Daniell et électrolyse
On réalise une pile Daniell ; la tension relevée aux bornes de cette pile est de 1,1 V.
1. Rappeler les équations aux électrodes, l’équation de pile et le principe de fonctionnement de cette
pile.
La pile Daniell est une pile cuivre-zinc ; la réaction spontanée entre les couples redox Cu2+(aq)/Cu(s) et
Zn2+(aq)/Zn(s) est celle de réduction de Cu2+(aq) par Zn(s). Ceci vous serait indiqué dans un sujet de bac.
Ainsi,

Chimie – Terminale S
Chapitre 7
Correction des exercices
3
Zn(s) = Zn2+(aq) + 2 e–(oxydation-anode)
Cu2+(aq) + 2 e– = Cu(s) (reduction-cathode)
Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
2. Que se passe-t-il si l’on laisse cette pile débiter indéfiniment ?
La réaction de pile consomme des ions Cu2+(aq) et du zinc métallique Zn(s) : lorsqu’on laisse la pile
débiter, ces réactifs finissent par s’épuiser et la réaction de pile s’arrête lorsque l’un des deux (ou les deux
s’ils sont en proportions stœchiométriques) a totalement disparu.
On intercale maintenant un générateur de tension continue entre les deux électrodes de la pile, la borne
(+) du générateur étant reliée à l’électrode de cuivre.
3. Quelle doit être la fém minimale du générateur ?
On réalise ici une électrolyse : cette dernière ne démarre qu’à partir d’un seuil de tension qui correspond à
la tension de débit de la pile inverse. Ainsi, le générateur doit avoir une fém minimale de 1,1 V.
4. Identifier les électrodes où se produisent les réactions d’oxydation et de réduction, et écrire les
demi-équations correspondantes.
5. Ecrire l’équation de la réaction associée à la transformation globale.
Cu(s) = Cu2+(aq) + 2 e–(oxydation-anode)
Zn2+(aq) + 2 e– = Zn(s) (reduction-cathode)
Zn2+(aq) + Cu(s) = Zn(s) + Cu2+(aq)
6. Cette transformation est-elle spontanée ? Justifier.
Cette transformation n’est pas spontanée : elle est inverse de la réaction de pile qui, elle, est une réaction
spontanée ; c’est pourquoi la réaction d’électrolyse nécessite un générateur afin de forcer une circulation
des porteurs de charge contraire à la circulation spontanée entre les espèces redox présentes.
7. Que se passe-t-il lorsqu’on débranche le générateur et qu’on le remplace par un voltmètre ?
En l’absence de générateur, la réaction d’électrolyse ne peut avoir lieu ; le voltmètre inséré ferme le
circuit et la réaction de pile, inverse de la réaction d’électrolyse imposée par le générateur, peut alors
démarrer et continuera jusqu’à l’épuisement de Cu2+(aq) et/ou de Zn(s).
En guise d’ouverture…
Pourquoi ne faut-il pas utiliser un générateur de tension continue lors d’un montage conductimétrique ?
Eh bien tout simplement pour éviter que la mesure conductimétrique ne s’entache d’une électrolyse
susceptible de modifier l’état électrolytique de la solution étudiée. On utilise donc, en conductimétrie, un
GBF (générateur basse fréquence) dont la tension alterne périodiquement et provoque l’inversion
périodique du courant électrique.
1
/
3
100%