Janvier 2017 - Université de Bourgogne

Université de Bourgogne 2016-2017
Licence Sciences de la Vie et de la Terre- L2 – Semestre 3 – UE2
Examen de Chimie Organique 1
Jeudi 5 janvier 2017 – 8h30-10h30 (11h10 tiers-temps)
L’utilisation du téléphone portable est interdite. Aucun document n’est autorisé.
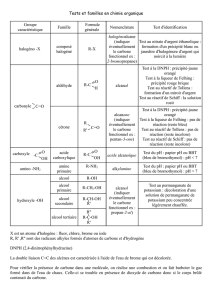
Exercice 1 :
La mifépristone ou RU-486 est un stéroïde de synthèse qui annihile les effets de la progestérone :
c’est la « pilule du lendemain ».
!
!
!
1) - Combien d’atomes de carbone sont hybridés sp2 ?
- Combien d’atomes de carbone sont hybridés sp ?
2) - Combien d’atomes de carbone asymétriques la molécule possède t’elle ?
- Quelle est la configuration absolue de l’atome de carbone indiqué par la flèche ?
3) Combien de doublets non liants sont présents sur cette molécule ?
4) Quelle est la particularité du groupe carbonyle dans cette molécule ?
Exercice 2 :
On considère la réaction de substitution nucléophile suivante :
La réaction est d'ordre partiel 1 par rapport au nucléophile et d’ordre partiel 1 par rapport à
l'halogénure d'alkyle.
1) Quelle est l'équation de vitesse de cette réaction ?
2) La vitesse de cette réaction dépend du solvant utilisé :
Solvant
k (vitesse relative)
µ (Debye)
Et2O
1
1,15
CH3COCH3
1300
2,69
Détailler le mécanisme de la réaction et justifier l'influence du solvant sur la vitesse de
substitution (le moment dipolaire µ traduit la polarité du solvant).
3) Connaissez-vous un autre mécanisme de substitution nucléophile ? Pourquoi ce dernier
n'est-il pas favorisé dans ce cas ?
NaN3 + CH3CH2CH2CH2Br NaBr + CH3CH2CH2CH2N3

Exercice 3 : Synthèse du but-2-ène. Réactivité du (E)-but-2-ène
1) Indiquer les réactifs I et II permettant la formation du but-2-ène.
2) Donner la structure des composés 1 à 7 en représentant le cas échéant les stéréoisomères.
3) Ecrire le mécanisme de la réaction permettant de former 5. Préciser s’il y a lieu la
régiosélectivité ou la stéréosélectivité de la réaction.
Exercice 4 :
Action d’un organomagnésien, CH3MgI, sur un ester, C6H5COOCH2CH3, puis hydrolyse acide du
milieu réactionnel.
1) Ecrire l’équation de la réaction de synthèse de l’organomagnésien.
2) Donner la structure du produit de la réaction sachant que celle-ci nécessite l’utilisation d’au
moins deux équivalents de réactif de Grignard.
3) Qu’obtient-on si un seul équivalent de réactif de Grignard est mis en jeu ?
4) Détailler le mécanisme de la réaction avec deux équivalents de réactif de Grignard.
Exercice 5 :
L’acide p-nitrobenzoïque peut être obtenu au départ du benzène suivant la synthèse suivante :
1) Donner le(s) réactif(s) nécessaire(s) pour réaliser chacune des trois étapes.
2) La première étape i) nécessite l’utilisation d’un catalyseur. Quelle est la définition d’un
catalyseur ? Quel est le rôle du catalyseur dans cette réaction ?
3) Lors de la deuxième étape ii), un deuxième composé se forme. Donner sa structure et
détailler le mécanisme de la réaction.
Au départ de l’acide benzoïque, on réalise la séquence de réactions suivante :
4) Donner les structures des composés I à IV.
5) Expliquer pourquoi, parmi les trois isomères possibles, l’isomère I est obtenu très
majoritairement.
Br III
KMnO4 dilué
à froid, pH neutre
KMnO4 concentré
pH acide, Δ
1) BH3
2) H2O2, OH-
Br2
1) O3
2) Zn, H2O
HBr
mCPBA
1
2
3
456
7
CH3CH3
NO2
COOH
NO2
i) ii) iii)
COOH
III III IV
HNO3/H2SO4Fe/HCl NaNO2/HCl
0°C F-

E
t
a
p
e
ii
:
S
t
ru
c
t
u
r
e
du d
e
u
x
i
è
m
e
c
o
m
p
os
é fo
r
m
é
e
t
m
éc
a
n
i
sm
e
d
e
l
a
r
é
a
c
t
i
o
n
0
)
C
0
N
V
.,_
b
'
<
Un
i
v
e
r
s
i
t
é
d
e
B
o
u
r
g
o
g
n
e
2
0
1
6
-
2
0
1
7
L
i
c
e
n
c
e
S
c
i
e
n
c
e
s
d
e
l
a
V
i
e
e
t
d
e
l
a
T
er
r
e
-
L
2
-
S
e
m
e
s
t
r
e
3
-
U
E
2
E
x
a
m
e
n d
e
C
h
i
m
i
e
O
r
ga
n
i
qu
e
1
-
5
j
a
n
v
i
e
r
2
0
1
7
-
F
e
u
ill
e
r
é
p
o
n
s
e
s
(
2
h
)
V
o
t
r
e
n
u
m
é
r
o
d
'
a
n
o
n
y
m
a
t
I
E
x
er
ci
c
e
1
/
J...,
1.
N
o
m
b
r
e
d
'
a
t
o
m
e
s
d
e
c
a
r
bon
e
h
yb
r
i
d
é
s s
p
2
:
1--L.
~
-----i
D
,
1
f"
N
om
b
r
e
d
'
a
t
o
m
e
s
d
e
c
a
r
bon
e
h
yb
r
i
d
é
s s
p
:
2
.
N
omb
r
e
d
'
a
t
o
m
e
s
d
e
c
a
r
bon
e a
s
ym
é
t
ri
q
u
e
s
:
C
o
n
fi
g
u
ra
t
i
o
n
a
b
s
o
l
u
e
d
e
l
'
a
t
o
m
e
d
e
c
a
r
b
o
n
e
:
3.
N
o
m
b
r
e
d
e
d
o
ub
l
e
t
s
n
on
l
i
a
n
t
s
:
4
.
P
a
rt
i
c
u
l
a
r
i
t
é
du
g
ro
up
e
c
a
r
b
ony
l
e
:
0
.
'\.
\
O
.
L
,
s
ti
.
s
5
o
.
i.
,
E
x
e
r
c
ic
e
2
/
~
M
é
c
a
n
i
s
m
e
d
e
l
a
r
é
a
c
t
i
o
n
e
t
j
u
s
t
i
fi
e
r
l'
i
n
fl
u
e
n
ce
du
s
o
l
v
a
n
t
s
u
r
l
a
v
i
t
e
ss
e
d
e
s
ub
s
t
i
t
u
t
i
on
ÔJ
\.
-
UJ
t
-
U.
'\
-
0t
-t
-
N
1.
J
L
t
L-
.l
+
N
~
\-\
r
À..
I
II I
II
I
V
CG-0
4
60-0
~
00
0
4
~
~
~
~
ÂJ_
e_pj;;_
'
Ch-1
,......
~
J.w,
f
~
~
(
~
j
0
0_.
œ,
e
~
~
(}vryO
CA,l
9..,M.
~
'---
!\J
O
L
_,.-
"
.
,ti-
F
,.._
~
~
'L
0 .
~
;l
l\J
L1
u
F
L
If\}
2-
CJ
()
.
,
0
.
\
0
,,.-
0
,
\
,
\
P
o
ur
q
u
o
i
,
p
a
rm
i l
e
s
tr
o
i
s
i
s
o
m
è
r
e
s
p
o
ss
i
b
l
e
s
,
l
'
i
s
o
m
è
r
e
I
e
s
t
-
i
l
o
b
t
e
n
u
t
r
è
s m
a
j
or
i
t
a
ir
e
m
e
n
t
?
E
x
p
l
i
q
u
e
r
A
u
t
r
e
m
é
ca
n
i
sm
e
d
e
s
u
b
s
t
i
t
u
t
i
o
n
n
u
cl
é
oph
il
e
?
P
ou
r
q
u
o
i
c
e
d
e
rn
i
e
r
n
'
e
s
t
-
i
l
p
a
s
fa
v
o
r
i
s
é
d
a
n
s
c
e
c
a
s
?
Ü
·
\
"
.
Ovv-
l

>
.
0
>-i
ô)
r)¾
i
~
ç-
~
dtj
.
-t
o)
\
l
'Yc)
G
®
'
Y
0
vv
1
~
Oî
~
'f'
J
f
~
~
-
J£
•
J
u
o
n
e
n
b
a
a
u
n
.m
d
.1
a
m
1
s
n
f
(
!
U
O
!J
J
B
~
.I
B
f
s
u
e
p
.1
0
.l
S
Â
f
B}
B
J
np
.l
lQ
ll
.1
0
.l
S
Â
f
B}
B
J
U
D
,
p
U
O
!l!
U
Y
~
O
_J
·
Q
_
\
'
9
j.
•
Q
~
'1
0'")
~
Q
"\4
W7t
h
if)
7
Yi
/
'
o
N
\-1
~
)
1
~
/
{J
x
Wù
(
!!!
(
s
)
J!
P
t?
~
lf
(
!!
(
s
)
J!
P
t?
~
lf
(
!
(
S
)
J
Jl
:l
t?
~
lf
I
-l
/
s
a
;,
p
.1
a
x
3
)
'
0
f
w:>
l
~
vn
-
?
-
~
d
\
h
à
I
~
W
£
H
:)
:)
p
S
l
U
:)
J
B
A
!
n
b
9
z:
:)
:)
A
B
U
O
!
P
l:?
?
J
B
J
:)
p
l
!
O
P
O
J
d
oJ\
~
IV\)
..S
·
o
--1
•
Q
~
K
_
/
A
V
_
t
1
l
,
--y'\f\}
i
/
1
\
C
-
'-...
(J
h
l-1
0
l
t1
~
L
9
I
-1 N-\f
~
s
.rw
l'!
5
· 0
v1
/
~
-
-,w
).
.
~
0
/
o
==-
/
.
Y
O
~
-+
~
0
.
rvv
"
loo
:,.,
-:-I
_
"
_J
'J,
"'
;
0
t
£
i
S
5
+-
j.
.
Q
2
h
N
/
¥J
N
5
·
0
_9
-t
~
<:...
-
V
3-
&--
h
1"V\j
r
n
,
,
f
ô
N
'
YI
o-0-
/
h
<f7/
I
'";t
~
-\
)
~
/
\
-!;
-
n
\
•
0
-r
~
~
~
.
Y)
7
~
1
Y\
0
C)V\
~
Y1S
:x)
'r
d
/
?
Y1
f"
h'::>
~
~
1
--0
1
II
(
s
)
J!
P
t?
~
lf
I
(
S
)
J!
P
t?
~
lf
'
1
/
4
100%