Immunité innée : le modèle drosophile Jean-Luc Imler1

Immunité innée : le modèle drosophile
Jean-Luc Imler1.
1CNRS, Institut de Biologie Moléculaire et Cellulaire, UPR 9022, 15 rue Descartes, 67000
Strasbourg.
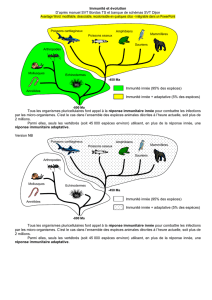
Chez tous les organismes multicellulaires, animaux comme végétaux, l’invasion par
des microorganismes est initialement combattue par des mécanismes de défense innée, qui
sont activés dans les minutes qui suivent l’infection. Chez les vertébrés, cette réponse rapide
est relayée par la réponse immunitaire adaptative, caractérisée par la production de récepteurs
spécifiques des antigènes par les lymphocytes. L’induction de la réponse immunitaire innée se
fait par des récepteurs qui détectent soit des motifs microbiens conservés (pattern recognition
receptors ou PRRs) ou des signaux de danger liés à l’infection.
La mouche du vinaigre Drosophila melanogaster est un des modèles favoris des
généticiens depuis le début du XXème siècle, et représente un modèle original pour étudier
les mécanismes moléculaires de l’immunité innée. Comme chez les mammifères, l’infection
microbienne déclenche chez la drosophile l’expression d’un grand nombre de gènes, qui
codent des facteurs permettant de contrôler l’infection, comme des peptides antimicrobiens.
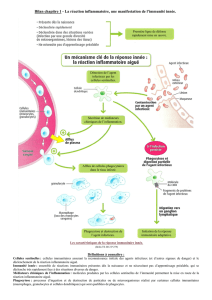
L’induction de ces gènes se fait au niveau transcriptionnel, et implique des facteurs de
transcription de la famille NF-κB. L’activité de ces facteurs de transcription, appelés DIF et
Relish, est régulée par deux voies de signalisation, dites respectivement Toll et IMD. Ces
deux voies de signalisation présentent de nombreuses analogies avec les voies des cytokines
interleukine-1 et TNF, qui jouent un rôle majeur dans l’inflammation chez les mammifères.
En outre, l’identification du rôle essentiel joué par le récepteur Toll dans la régulation de la
réponse antimicrobienne chez la drosophile a mené à l’identification d’une famille de
récepteurs apparentés à Toll chez les mammifères, les Toll-like receptors ou TLRs, qui
forment une importante famille de PRR.
La résistance aux infections virales implique quand à elle les mécanismes de l’ARN
interférence, qui jouent un rôle essentiel dans la défense contre les virus chez les plantes.
Cette défense innée semble avoir été remplacée par les réponses induites par les interférons
chez les mammifères. Les PRRs qui détectent les acides nucléiques viraux et induisent les
interférons chez les mammifères font cependant partie de la même famille d’hélicases à boîte
DExD/H que les enzymes Dicer impliquées dans l’ARN interférence, suggérant une origine
évolutive commune pour ces deux types de défense antivirale.
En résumé, l’étude de l’immunité innée chez la drosophile fournit des indications
précieuses sur l’évolution des mécanismes de défense de l’hôte chez les organismes
multicellulaires. Les études dans le modèle drosophile peuvent également avoir des
implications pour d’autres insectes diptères, notamment les moustiques Aedes et Anopheles,
qui transmettent des maladies virales ou parasitaires à l’Homme.
1
/
1
100%