Liste Rouge provisoire des Odonates des Antilles françaises

L
Li
is
st
te
e
R
Ro
ou
ug
ge
e
p
pr
ro
ov
vi
is
so
oi
ir
re
e
d
de
es
s
O
Od
do
on
na
at
te
es
s
d
de
es
s
A
An
nt
ti
il
ll
le
es
s
f
fr
ra
an
nç
ça
ai
is
se
es
s
et liste des espèces à suivi prioritaire
G
GU
UA
AD
DE
EL
LO
OU
UP
PE
E
e
et
t
M
MA
AR
RT
TI
IN
NI
IQ
QU
UE
E
Coordination : François Meurgey
Comité de pilotage : Gwenaël David, François
Meurgey, Lionel Picard, Céline Poiron et Karl
Questel
Octobre 2012

Ce travail doit être cité de la manière suivante :
[MEURGEY F., (Coord.) et al., 2012. Liste Rouge provisoire des Odonates des Antilles Françaises et
liste des espèces à suivi prioritaire.
Guadeloupe et Martinique
Société d’Histoire Naturelle L’Herminier (SHNLH), 57 p.]
© Société d’Histoire Naturelle L’Herminier
OCTOBRE 2012
Société d’Histoire Naturelle L’Herminier
Muséum d’Histoire Naturelle
12, rue Voltaire 44000 Nantes
http://www.shnlh.org

Liste Rouge provisoire des Odonates des Antilles françaises
et liste des espèces à suivi prioritaire.
Guadeloupe et Martinique
Mots clés : ODONATES, ANTILLES FRANCAISES, LISTE ROUGE, UICN.
Key words : ODONATA, FRENCH WEST INDIES, RED LIST, IUCN.
Résumé : Une Liste Rouge des Odonates des Antilles françaises est présentée. La méthodologie
utilisée suit les modalités d’application nationale du protocole de l’UICN.
La démarche adoptée est l’évaluation du statut de chacune des espèces de la faune des Antilles
françaises pour obtenir un classement selon les catégories proposées par l’UICN. L’évaluation a été
réalisée à partir des conditions d’éligibilité (période de référence, indigénat…), puis au travers de
critères « espèces » et « habitats ».
Les critères « espèces » regroupent, 1) l’analyse des données du programme ODO-AF, 2) d’autres
critères comme la fragmentation des populations, l’endémisme, … Les critères « habitats » ont été
ajoutés et prennent en compte les espèces euryèces, qui utilisent des milieux variés, globalement
peu ou pas menacés, et les espèces sténoèces, qui se développent dans une gamme plus réduite
d’habitats, davantage menacés. Les difficultés rencontrées montrent que la seule utilisation d’une
base de données d’inventaire n’est pas suffisante pour une telle évaluation et qu’il est important de
compléter l’analyse par l’utilisation de critères à dire d’experts.
La Liste Rouge des Odonates menacés de Guadeloupe concerne 28% de la faune des libellules, dont
une est en danger critique d’extinction, quatre sont en danger et quatre autres vulnérables. Pour la
Martinique, la liste rouge concerne 39% des espèces, soit plus d’un tiers de la faune odonatologique,
dont quatre sont considérées comme disparues, trois sont en danger et quatre autres vulnérables.
Les espèces en Liste Rouge et celles classées dans la catégorie « Quasi menacé » sont intégrées dans
le programme de suivi des espèces prioritaires de la SHNLH. La Liste Rouge des Odonates menacés
des Antilles françaises a été établie à la suite du programme régional d'inventaire mené de 2000 à
2012, important travail qui a permis de dresser un inventaire bibliographique complet et de récolter
plus de 5 000 données originales.
Cette Liste Rouge se veut un outil au service des politiques de préservation des écosystèmes et des
espèces. Certaines actions peuvent et doivent être engagées rapidement. Quelques espèces
d'Odonates voient en effet leur situation se dégrader de façon évidente au point de rendre très
précaire leur conservation dans le patrimoine naturel régional.
Cette Liste Rouge est un document provisoire et sera soumis à validation par
le Comité Français de l’UICN.
_____________________________________

SOMMAIRE
PREAMBULE ............................................................................................................................................. 1
REMERCIEMENTS .................................................................................................................................... 3
INDEX DES ESPÈCES ................................................................................................................................. 5
1.MÉTHODOLOGIE D'ÉTABLISSEMENT DE LA LISTE ROUGE RÉGIONALE ................................................ 7
1.1 Description du lot de données. ..................................................................................................... 7
1.2 Le principe des critères UICN. ....................................................................................................... 8
1.2.1 Catégories de menace applicables au niveau régional. ......................................................... 8
1.2.2 Critères pour le classement dans les catégories CR, EN et VU. ............................................. 9
1.2.3 Directives pour établir une Liste Rouge régionale ............................................................... 11
1.3 Critères retenus pour établir la Liste Rouge ............................................................................... 12
1.3.2 Taxons pris en compte ......................................................................................................... 12
1.3.3 Critères appliqués ................................................................................................................ 12
1.3.4 Procédure adoptée .............................................................................................................. 13
1.3.4.1. Calcul des AOO et des EOO .............................................................................................. 13
1.3.4.2. Ajustement des critères ................................................................................................... 13
1.3.5. Désignation des espèces considérées comme éteintes dans les Antilles françaises (RE) .. 14
2. LISTE ROUGE DES LIBELLULES MENACÉES EN GUADELOUPE ............................................................ 15
2.1 COMMENTAIRES SPECIFIQUES ........................................................................................................ 17
2.1.1 Les espèces de la Liste Rouge .................................................................................................. 17
2.1.2 Les espèces au bord de l'extinction (CR). ............................................................................ 17
2.1.3 Les espèces en danger (EN). ................................................................................................ 18
2.1.4 Les espèces vulnérables (VU) .............................................................................................. 20
2.1.5 Les autres espèces ................................................................................................................... 23
2.1.5.1 Les espèces quasi menacées (NT). .................................................................................... 23
2.1.5.2 Les espèces pour lesquelles les données sont insuffisantes (DD). ................................... 24
2.1.5.3. Les espèces non évaluées (NE). ....................................................................................... 26
3. LISTE ROUGE DES LIBELLULES MENACÉES EN MARTINIQUE ............................................................. 27
3.1 COMMENTAIRES SPECIFIQUES ........................................................................................................ 29
3.1.1. Les espèces de la Liste Rouge ................................................................................................. 29
3.1.1.1 Les espèces éteintes (RE). ................................................................................................. 29
3.1.1.2. Les espèces en danger (EN). ............................................................................................ 29
3.1.1.3. Les espèces vulnérables (VU) .......................................................................................... 31
3.1.3. Les autres espèces .................................................................................................................. 33
3.1.3.1 Les espèces quasi menacées (NT). .................................................................................... 33
3.1.4. Les espèces pour lesquelles les données sont insuffisantes (DD). ..................................... 34
3.1.5. Les espèces non évaluées (NE). .......................................................................................... 35
4. ESPECES A SUIVI PRIORITAIRE ........................................................................................................... 36
5. DISCUSSION ....................................................................................................................................... 38
5.1. Interprétation des résultats ........................................................................................................... 38
Liste des experts et contributeurs ......................................................................................................... 41
6. BIBLIOGRAPHIE CONSULTEE .............................................................................................................. 42
ANNEXE 1 : Tableau synthétique des données par ordre alphabétique des espèces en Guadeloupe . 51
ANNEXE 2 : Tableau synthétique des données par ordre alphabétique des espèces en Martinique. . 52

L i s t e R o u g e d e s O d o n a t e s d e s A n t i l l e s f r a n ç a i s e s
Page 1
PREAMBULE
En 1987 était publiée la première Liste Rouge des Odonates de France. Cette liste, s’intégrait dans un
travail plus global destiné à faire le point sur les connaissances relatives à la faune, aux habitats et
aux sources d’informations disponibles (DOMMANGET, 1987). Depuis les années 1980,
l’odonatologie française s’est développée de manière spectaculaire. La mise en place de l’Inventaire
cartographique des Odonates de France (programme Invod), la naissance de la revue Martinia, la
création de la Société française d’Odonatologie, ont de toute évidence largement contribué à
l’amélioration des connaissances sur les Odonates de France.
Sur un autre plan, les avancées technologiques sur les systèmes d’information géographique, de
géoréférencement et l’amélioration des performances des bases de données permettent une toute
autre approche de l’inventaire de notre patrimoine biologique. Les bases de données de faune et de
flore se multiplient, annonçant une surveillance de plus en plus précise des éléments
environnementaux de toute nature.
Dans les Antilles….
Les Odonates de France (ainsi que leur étude et prise en compte dans les mesures
environnementales de préservation des habitats) sont en général abordés sous l’angle de la faune
métropolitaine (98 taxons), séparément des faunes dites « exotiques ». Mais, si l’on considère
l’ensemble des espèces qui composent la faune de France (c'est-à-dire des COM compris), nous
arrivons au total vertigineux de plus de 440 espèces (Meurgey, 2006a), soit de manière plus imagée
8% de la faune mondiale. C’est dire la responsabilité de la France en matière de conservation de ce
groupe d’insectes.
Paradoxalement, les connaissances manquent encore sur de nombreux territoires ultramarins,
comme les Antilles françaises. Ce manque de connaissances tient en grande partie au trop petit
nombre de chercheurs français intéressés par cette discipline dans le passé, et à la pauvreté des
collections. De nos jours, la plupart des entomologistes qui désirent étudier les libellules des Antilles
doivent avoir recours à une littérature dispersée, souvent en langue anglaise et difficile à obtenir.
Celle-ci ne concerne bien souvent pas les Antilles, mais plus généralement le continent américain. La
faunistique (répartition des espèces) a été favorisée au détriment de la systématique, de la biologie
et de l’écologie, aspects dont la connaissance est un prérequis à toute mesure de protection ou de
gestion. La récente publication d’un ouvrage de synthèse sur les Odonates des Antilles françaises
apporte désormais une somme de connaissances qui, même si de nombreux aspects de la vie des
libellules demeurent peu connus, nous permet de pousser plus loin nos investigations, notamment
en ce qui concerne la conservation de cet ordre d’insectes.
Le domaine biogéographique néotropical, auquel appartiennent les Antilles, compte aujourd’hui
environ 1650 espèces, et la diversité y est telle que de nouvelles espèces pour la science sont
décrites chaque année dans les revues scientifiques. L’odonatofaune des Antilles se compose
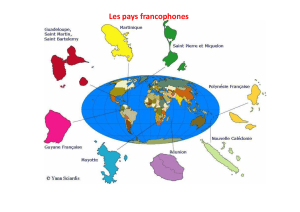
actuellement de 111 espèces, parmi lesquelles une importante proportion d’endémiques.
Les îles qui composent les Antilles françaises sont les plus éloignées des foyers de dispersion que sont
l’Amérique du Sud et les Grandes Antilles. Elles ont vu se développer au fil du temps une faune et
une flore qui leur sont spécifiques et, à beaucoup d’égards, uniques au monde. Parmi les 41 espèces
de libellules recensées en Guadeloupe et en Martinique, 5 ne sont présentes que dans cette région
du monde, moins grande qu’un département de l’hexagone.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
1
/
57
100%