sanofi belgium - E

Société pharmaceutique
(SANOFI BELGIUM)
1. Dénomination du médicament
Rulid 150 mg comprimés pelliculés
2. Composition qualitative et quantitative
Rulid 150 mg comprimés pelliculés
Chaque comprimé pelliculé contient 150 mg de roxithromycine comme principe actif.
Excipients: glucose.
Pour la liste complète des excipients, voir rubrique 6.1.
3. Forme pharmaceutique
Rulid 150 mg comprimés pelliculés
Comprimé pelliculé, destiné à la voie orale
4. Données cliniques
4.1 Indications thérapeutiques
Comme avec tout autre antibiotique, il est conseillé avant toute prescription, de consulter les directives sur la prévalence de résistance
locale et la pratique médicale y associée en ce qui concerne la prescription d’antibiotiques. Environ 40% des pneumocoques et 10%
des streptocoques du groupe Lancefield A (S. pyogenes) sont résistants à la roxithromycine. La roxithromycine n’est pas
recommandée pour le traitement empirique d’infections dont ces bactéries sont les causes fréquentes. Une fois le microorganisme isolé
et la sensibilité déterminée, la roxithromycine, comme alternative aux antibiotiques β-lactames (par exemple en cas d’hypersensibilité),
peut être utilisée dans les indications suivantes:
- Infections respiratoires basses: bronchite bactérienne aiguë ou poussée purulente de bronchite chronique causées par S. pneumoniae
ou Haemophilus influenzae ou Moraxella catarrhalis. La pneumonie n’est pas une indication étant donné que seule la forme orale
de Rulid est disponible.
- Infections respiratoires hautes:
- Pharyngite due à S. pyogenes
- Otite moyenne due à Haemophilus influenzae, S. pneumoniae, S. pyogenes et Moraxella catarrhalis.
- Sinusite due à S. pneumoniae, S. pyogenes, Staphylococcus aureus et aux anaérobies.
- Infections génitales causée par Chlamydia trachomatis et Ureaplasma urealyticum.
- Infections de la peau telles que l’impétigo et l’érysipèle causées par S. pyogenes ou S. aureus.
4.2 Posologie et mode d'administration
1. Population pédiatrique:
La dose moyenne utilisée dans les essais cliniques pédiatriques a été de 6 mg/kg/jour.
La posologie recommandée est de 6 mg/kg/jour, répartie en 2 prises à 12 heures d’intervalle.
Le traitement ne sera pas prolongé au-delà de 10 jours.
De préférence, le Rulid sera administré environ 1/4 d'heure avant les repas.
2. Adultes (à partir de 40 kg):
Rulid 150 mg (comprimés à 150 mg)
300 mg/jour, soit 1 comprimé matin et soir.
- Chez les insuffisants hépatiques, on constate une augmentation de la demi-vie plasmatique.
Par précaution, la prescription de Rulid doit être soigneusement évaluée.
Si elle est jugée nécessaire, il conviendra de surveiller les tests hépatiques et de diminuer éventuellement la posologie.
- Chez les insuffisants rénaux, l'élimination rénale de la roxythromycine et de ses métabolites étant faible (+/- 10% de la dose orale) et
la modification des paramètres pharmacocinétiques n'étant pas corrélée à la clearance de la créatinine une modification de la posologie
n'est pas nécessaire.
- Chez les sujets âgés, la demi-vie est allongée.
Cependant, après administration répétée de 150 mg toutes les 12 heures, les concentrations plasmatiques maximales (11,3 mg/l) et
l'aire sous la courbe à l'état d'équilibre entre 2 prises de Rulid, ne sont que légèrement supérieures à celles obtenues chez le sujet jeune.

Il n'est donc pas nécessaire de modifier la posologie chez les sujets âgés.
De préférence, Rulid sera administré environ ¼ d'heure avant les repas.
4.3 Contre-indications
- Hypersensibilité à la substance active ou à un des excipients.
- Allergie connue aux macrolides.
- Association aux alcaloïdes vasoconstricteurs de l’ergot de seigle, notamment l’ergotamine et la dihydroergotamine (voir rubrique 4.5).
- co-administration avec des médicaments aux indications thérapeutiques étroites et qui sont des substrats du CYP3A4 (par ex.
astémizole, cisapride, pimozide et terfénadine) (voir rubriques 4.4 et 4.5).
- En cas d’insuffisance hépatique grave, l’administration de roxithromycine est déconseillée.
4.4 Mises en garde spéciales et précautions d'emploi
Avertissement
Une vasoconstriction sévère (« ergotisme ») avec une possibilité de nécrose des extrémités a été rapportée lorsque des antibiotiques
macrolides ont été associés à des alcaloïdes vasoconstricteurs de l’ergot de seigle. Avant de prescrire de la roxithromycine, il faut
toujours vérifier l’absence de traitement par ces alcaloïdes (voir rubrique 4.4).
Précautions
- La survenue de toute manifestation allergique nécessite l'arrêt du traitement.
- Comme pour tout antibiotique, des cures prolongées et répétées favorisent le développement de germes non sensibles ou de
mycoses.
En cas d’insuffisance hépatique sévère, l’utilisation de roxithromycine n’est pas recommandée.
- La roxithromycine devrait être utilisée avec prudence chez les patients souffrant d’une déficience hépatique légère à modérée.
- Il n’est pas nécessaire d’ajuster la dose pour les patients âgés.
- Des anomalies du cartilage de croissance ont été observées chez le jeune animal à des concentrations plasmatiques de la forme libre
30 à 60 fois supérieures à celles observées en clinique. Aucune anomalie n'ayant été observée à des concentrations plasmatiques de la
forme libre 10 à 15 fois supérieures à celles observées en clinique, il est recommandé de limiter la posologie à 5-8 mg/kg/jour pendant
une période maximale de 10 jours.
- Il existe une résistance croisée entre les macrolides (érythromycine, roxithromycine, clarithromycine pour les macrolides dont le cycle
comporte 14 atomes; azithromycine pour les macrolides dont le cycle comporte 15 atomes; spiramycine pour les macrolides dont le
cycle comporte 16 atomes).
Médicaments susceptibles d’allonger l’intervalle QT. La prudence est recommandée lorsque la roxithromycine est administrée à des
patients prenant d’autres médicaments susceptibles d’allonger l’intervalle QT (voir rubrique 4.5). Ces derniers incluent les agents
antiarythmiques de classe IA (par ex. quinidine, procaïnamide, disopyramide) et de classe III (par ex. dofétilide, amiodarone), le
citalopram, les antidépresseurs tricycliques, la méthadone, certains neuroleptiques (par ex. phénothiazines), des fluoroquinolones (par
ex. moxifloxacine), certains antifongiques (par ex. fluconazole, pentamidine) et certains antiviraux (par ex. télaprévir).
- L’excrétion rénale de la roxithromycine et de ses métabolites représente environ 10 % d’une dose orale. En cas d’insuffisance rénale,
la posologie devrait rester inchangée.
- Comme décrit pour les autres macrolides, la roxithromycine peut aggraver la myasthénie grave.
- Une allergie croisée est également possible avec la télithromycine.
- Il est recommandé de surveiller les fonctions hépatique et rénale ainsi que la numération sanguine, surtout en cas de traitement de
longue durée. (c.-à-d. supérieure à 2 semaines) (rubrique 4.8)
- Maladie associée au Clostridium difficile : La diarrhée, surtout si elle est sévère, persistante et/ou sanglante, pendant ou après le
traitement à la roxithromycine peut être symptomatique d’une colite pseudomembraneuse. En cas de soupçon de colite
pseudomembraneuse, la roxithromycine doit être arrêtée immédiatement.
Rulid 150 mg contient du glucose et est contre-indiqué chez les patients présentant une intolérance au galactose, un déficit en lactase de
Lapp ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares).
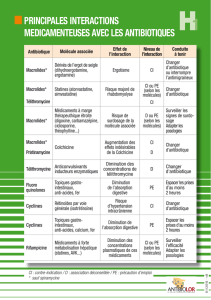
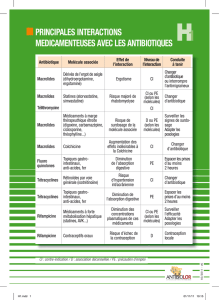
4.5 Interactions avec d'autres médicaments et autres formes d'interactions
Interactions contre-indiquées :
Produits à base d’ergotamine ou d’autres dérivés vasoconstricteurs de l’ergot de seigle

Des manifestations d'ergotisme avec possibilité de nécrose des extrémités ont été rapportées après l'emploi simultané de macrolides et
de produits à base d'ergotamine ou d'autres dérivés vasoconstricteurs de l'ergot de seigle.
De telles associations sont contre-indiquées. Avant de prescrire la roxithromycine il faut se rassurer que le patient n’est pas traité par
ces alcaloïdes.
Astémizole, pimozide, cisapride
Certains macrolides peuvent inhiber la métabolisation de l’astémizole, la pimozide, la cisapride par l’isoenzyme hépatique CYP3A et
augmenter la concentration sérique de ces médicaments. Des concentrations élevées de ces médicaments ont été associées à des
troubles cardiovasculaires comme prolongation de l’intervalle QT et/ou arythmies (typiquement des torsades de pointe) et arrêt
cardiaque. Bien que la roxithromycine n’a pas de capacité ou seulement une capacité limitée de complexer le CYP3A et de cette façon
inhiber la métabolisation d’autres produits métabolisés par cet iso-enzyme, la possibilité d’interactions cliniques entre la roxithromycine
et les médicaments susmentionnés ne peut être exclu. La prise concomitante de la roxithromycine et de ces médicaments est contre-
indiquée.
Terfénadine
Une interaction pharmacocinétique entre la terfénadine et certains macrolides est possible ce qui peut augmenter la concentration
sérique de la terfénadine. Ceci peut conduire à des arythmies ventriculaires graves, typiquement des torsades de pointe. Bien que cette
réaction ne c’est pas présentée avec la roxithromycine et des études chez un nombre limité de volontaires sains n’ont pas démontrées
d’interactions farmacocinétiques ni de changements importants dans l’ECG, l’association de la roxithromycine et la terfénadine est
contre-indiquée.
Inhibiteurs de l’HMG-CoA réductase
Lorsque la roxithromycine et un inhibiteur de l’HMG-CoA réductase (statine) sont associés, il existe un risque potentiel d’évènements
indésirables de type musculaires, tels que la rhabdomyolyse, en raison d’une éventuelle augmentation de l’exposition à la statine. Il
convient d’être prudent lorsqu’une statine est associée à la roxithromycine, et les patients doivent être surveillés pour l’apparition des
signes et symptômes de la myopathie.
Interactions non recommandées :Médicaments susceptibles d’allonger l’intervalle QT
La prudence est recommandée lorsque la roxithromycine est administrée à des patients prenant d’autres médicaments susceptibles
d’allonger l’intervalle QT (voir rubrique 4.4). Ces derniers incluent les agents antiarythmiques de classe IA (par ex. quinidine,
procaïnamide, disopyramide) et de classe III (par ex. dofétilide, amiodarone), le citalopram, les antidépresseurs tricycliques, la
méthadone, certains neuroleptiques (par ex. phénothiazines), des fluoroquinolones (par ex. moxifloxacine), certains antifongiques (par
ex. fluconazole, pentamidine) et certains antiviraux (par ex. télaprévir).
Warfarine et autres anticoagulants
Aucune interaction avec la warfarine n’a été observée lors d’études sur des volontaires ; néanmoins, des augmentations du temps de
prothrombine ou du Rapport international normalisé (RIN) qui peuvent s’expliquer par l’épisode infectieux ont été rapportées chez des
patients traités par roxithromycine et par antagonistes de la vitamine K. Surveiller le RIN lors d’un traitement combiné par
roxithromycine et par antagonistes de la vitamine K est une pratique prudente.
Disopyramide
Une étude in vitro a montré que la roxithromycine peut déplacer la disopyramide liée aux protéines ; un tel effet in vivo peut entraîner
une augmentation des taux sériques de disopyramide libre. Il faut donc surveiller l’ECG et ,si possible, les taux sériques de
disopyramide.
Précautions d’emploi
Digoxine et autres glycosides cardiaques
Une étude chez le volontaire sain a démontrée que la roxithromycine peut augmenter l’absorption de la digoxine et d’autres glycosides
cardiaques. Cet effet, commun à tous les macrolides peut résulter rarement en une augmentation de la toxicité des glycosides
cardiaques. Les symptômes sont: nausées, vomissements, diarrhée, céphalées ou vertiges, arythmies. Les patients traités en même
temps par des glycosides cardiaques et des macrolides doivent être rigoureusement suivis et au moindre signe un surdosage en
glycosides cardiaques doit être soupçonné.
La roxithromycine, comme les autres macrolides, devrait être utilisée avec précaution chez les patients prenant des agents
antiarythmiques de classes IA et III.
Interactions à prendre en compte :
Théophylline
Chez l'adulte, des études cliniques ont montré une faible interaction pharmacocinétique avec la théophylline chez le sujet sain, ne
nécessitant généralement pas d'adaptation posologique chez le malade. Chez l'enfant néanmoins, étant donné la faible marge
thérapeutique de sécurité, une certaine prudence est recommandée.
Ciclosporine

Lors d’une étude clinique visant à évaluer les effets de la roxithromycine sur une exposition à la cyclosporine, 8 transplantés cardiaques
traités à la cyclosporine durant au moins 1 mois ont reçu 150 mg 2 fois par jour de roxithromycine durant 11 jours. La roxithromycine
a entraîné une augmentation de 50 % des concentrations plasmatiques de cyclosporine, qui ont progressivement diminué à l’arrêt de la
roxithromycine. En général les doses de ciclosporine ne doivent pas être adaptées.
Bromocriptine
En cas d'association avec la bromocriptine, il sera nécessaire de prendre en compte l'augmentation des taux plasmatiques de la
bromocriptine avec renforcement possible de l'activité antiparkinsonienne ou l’apparition de signes de surdosage dopaminergique
(dyskinésies ...).
Autres antibiotiques
Il n'est pas recommandé d'associer plusieurs antibiotiques entre eux.
Midazolam (benzodiazépines)
Une co-administration de roxithromycine (300 mg par jour) et de midazolam (15 mg par ingestion) a causé une augmentation de 47 %
de la dose ASC du midazolam (un substrat sensible du CYP3A4), ce qui peut accroître les effets du midazolam.
Les antibiotiques du groupe des macrolides peuvent inhiber les enzymes hépatiques intervenant dans la métabolisation des
benzodiazépines ce qui résulte en une augmentation des concentrations sériques des benzodiazépines due à une diminution de leur
métabolisation, une prolongation du temps de demi-vie et un volume de distribution augmenté. Ceci augmente la toxicité des
benzodiazépines (dépression du système nerveux central, ataxie, léthargie). Les patients traités en même temps par des
benzodiazépines et des macrolides doivent être rigoureusement suivis. Il est possible que la dose des benzodiazépines doit être
diminuée.
Rifabutine
La roxithromycine peut accroître la concentration plasmatique de la rifabutine.
Autres :
Il n’y a pas d’interactions cliniques pertinentes avec la carbamazépine, la rantidine, l’hydroxyde d’aluminium ou de magnésium. Des
études visant à évaluer les effets de la roxithromycine sur les contraceptifs oraux contenant des œstrogènes et progestogènes, bien que
sur un nombre très faible de sujets, ne montrent pas d’interactions cliniques.
4.6 Fertilité, grossesse et allaitement
Grossesse
L'innocuité de la roxithromycine n'a pas été établie chez la femme enceinte. Les études effectuées sur plusieurs espèces animales n'ont
pas montré d'action tératogène ou fœtotoxique, jusqu'à la dose de 200 mg/kg/j.(soit 40 fois la dose humaine).
L’innocuité de la roxithromycine pour le fœtus n’a pas été établie lors de la grossesse humaine.
Allaitement
Le passage de roxithromycine dans le lait est très faible (moins de 0,05% de la dose ingérée). L’allaitement ou le traitement de la mère
devraient dès lors être arrêtés si nécessaire.
4.7 Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les risques de sensations vertigineuses peuvent réduire la capacité nécessaire à l’exécution de certaines tâches, telles que conduire ou
utiliser des machines.
4.8 Effets indésirables
Système
d’organes
classe
Très
fréquent
(> 1/10)
Fréquent
(≥ 1/100 à
< 1/10)
Peu
fréquent
(≥ 1/1000 à
< 1/100)
Inconnu (ne peut
être estimé sur la base
des
données disponibles)
Infections et
infestations
Surinfection (lors d’usage
prolongé)
Colite à Clostridium difficile
(colite pseudomembraneuse)
Affections
hématologiques
et du système
lymphatique
Éosinophilie Agranulocytose
Neutropénie
Thrombocytopénie
Affections du
système
immunitaire
Choc anaphylactique

Affections de
l’oreille et du
labyrinthe
surdité transitoire,
hypoacousie, vertiges et
acouphènes
Affections
psychiatriques
Hallucinations, etat
confusionnel (confusion
mentale)
Affections du
système nerveux
Etourdissements
Céphalées
Paresthésie
Dysgueusie (trouble du goût)
Agueusie
Parosmie (perturbation de
l’odorat)
Anosmie
Affections
respiratoires,
thoraciques et
médiastinales
Bronchospasme
Affections
gastro-
intestinales
Nausées
Vomissements
Dyspepsie
(douleur
d’estomac)
Diarrhée
Diarrhée hémorragique
Pancréatite
Affections
hépatobiliaires
Hépatite cholestatique
(hépatite cholestatique ou
hépatocellulaire aiguë)
Affections de la
peau et du tissu
sous-cutané
Éruption cutanée Érythème
polymorphe
Urticaire
Œdème de Quincke
Purpura
Syndrome de Stevens-
Johnson
Nécrolyse épidermique
toxique
Investigations Augmentation de l’aspartate
aminotransférase
(ASAT)
Augmentation de l’alanine
aminotransférase (ALAT)
Phosphatase alcaline
sanguine
accrue
Affections
cardiaques (1)
Allongement de l’intervalle
QT Tachycardie ventriculaire
Torsade de pointes
(1) Comme pour les autres macrolides, les cas d’allongement QT, de tachycardie ventriculaire et de torsades de pointes ont été
rarement rapportés pour la roxithromycine.
4.9 Surdosage
Des symptômes d’un surdosage avec un antibiotique du groupe des macrolides sont: nausées sévères, vomissements et diarrhée.
Conduite en cas de surdosage: lavage gastrique et traitement symptomatique. Il n'existe pas d'antidote spécifique.
5. Propriétés pharmacologiques
5.1 Propriétés pharmacodynamiques
Classe pharmacothérapeutique: antibactérien pour usage systémique
Code ATC: J01FA06.
La roxythromycine est un antibiotique de la famille des macrolides, dérivé semi-synthétique de l'érythromycine.
Mode d’action :
La roxithromycine agit sur la synthèse des protéines des bactéries en se fixant sur leurs ribosomes cytoplasmiques.
Rapport PK/PD :
Le rapport AUC/MIC (aire sous la courbe/concentration minimale inhibitrice) est le paramètre qui prévoit le mieux l’efficacité de la
roxithromycine.
Mécanismes de résistance :
 6
6
 7
7
 8
8
 9
9
1
/
9
100%