Chimie - Fonction publique

CONCOURS SUR ÉPREUVES OUVERT AUX CANDIDATS TITULAIRES
D’UN DIPLÔME OU TITRE CONFÉRANT LE GRADE DE MASTER OU
D'UN DIPLÔME OU TITRE HOMOLOGUÉ OU ENREGISTRÉ AU
RÉPERTOIRE NATIONAL DES CERTIFICATIONS PROFESSIONNELLES
AU NIVEAU I
-------
CONCOURS SUR ÉPREUVES OUVERT AUX FONCTIONNAIRES CIVILS
DE L’ÉTAT, DES COLLECTIVITÉS TERRITORIALES, D’UN
ÉTABLISSEMENT PUBLIC OU D’UN ORGANISME INTERNATIONAL
COMPTANT AU MOINS CINQ ANS DE SERVICE DANS UN CORPS DE
CATEGORIE A OU ASSIMILÉ
SESSION 2012
É PREUVE A OPTION
(durée : 4 heures – coefficient : 6 – note éliminatoire 4 sur 20)
CHIMIE
Pour l'épreuve optionnelle de chimie, l'usage de calculatrices programmables,
alphanumériques ou à écran graphique est autorisé à condition que leur
fonctionnement soit autonome et qu'il ne soit pas fait usage d'imprimante. La
consultation des notices de fonctionnement reste interdite.
1/9

Exercice I - Biocarburants
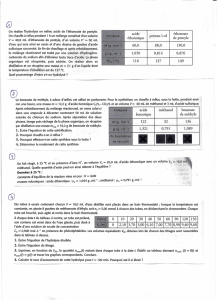
Données :
Nom Méthanol Huile de
colza
Linoléate de
méthyle Glycérol
Densité 0,79 0,82 0,90 1,25
Masse molaire (g/mol.) M2 = 32 M1 = 878 M3 = 294 M4 = 92
Température d’ébullition (°C) sous pression
normale 65 >200 >200 148
Tableau de miscibilité
Méthanol Linoléate de méthyle Glycérol
Méthanol xxxxxxx miscible miscible
Linoléate de
méthyle miscible xxxxxxxx non miscible
En 1987, la France a autorisé la fabrication de carburants d’origine agricole : les biocarburants.
Ils sont destinés à être incorporés aux autres carburants. On trouve parmi ceux-ci les esters
méthyliques d’huiles végétales : on les synthétise à partir d’huile de colza ou de tournesol et de
méthanol. On se propose d’étudier ici une synthèse du linoléate de méthyle telle qu’elle est
effectuée dans un laboratoire.
Réactifs :
- une masse m1 d’huile de colza que l’on considérera exclusivement constituée de trilinoléate
de glycéryle. Dans les applications numériques, on prendra m1 =293 g ;
- une masse m2 = 80 g de méthanol anhydre.
- un catalyseur.
Le mélange réactionnel est introduit dans un ballon, muni d’un agitateur magnétique et chauffé à
reflux à 80°C pendant une heure. On sépare ensuite l’ester par décantation. Enfin ce dernier est
purifié par distillation.
1 - On peut aussi obtenir le linoléate de méthyle par une autre réaction d’estérification entre l’acide
oléique de formule R-COOH ( avec R = C17H31 ) et le méthanol de formule CH3-OH.
- Écrire la formule semi-développée du linoléate de méthyle en faisant clairement apparaître le
groupe fonctionnel ester (ne pas développer R ).
- Écrire l’équation de la réaction entre l’acide oléique et le méthanol.
2/9

2 - La réaction du protocole du laboratoire correspond à un autre mécanisme ; son bilan
stœchiométrique est :
{1 mole de trilinoléate de glycéryle + 3 moles de méthanol ---> 3 moles de linoléate de méthyle +
1mole de glycérol }
- Calculer la masse m2 de méthanol qu’il faudrait faire réagir avec la masse m1 d’huile de colza dans
les conditions stœchiométriques.
- En déduire le réactif en excès.
3 - Calculer la masse maximale m3 théorique de linoléate de méthyle que l’on peut espérer
récupérer si l’on considère la réaction comme totale.
- Quelles sont les espèces présentes dans le milieu réactionnel à la fin de la réaction ?
- A l’aide du tableau de données, justifier la nature du produit chimique éliminé par distillation.
- Sachant que le rendement de la réaction est de l’ordre de 70 %, choisir parmi les trois valeurs
proposées, celle du volume d’ester obtenu : 190 mL ; 228 mL ; 401 mL.
4 - Le catalyseur doit être utilisé en faible quantité pour éviter une réaction parasite : il contient des
ions hydroxyde qui sont susceptibles de réagir avec le trilinoléate de glycéryle dont la formule est
donnée ci-dessous :
Écrire l’équation de cette réaction. De quel type de réaction s’agit-il ?
Exercice II - Airbag
Lors d'un impact justifiant le déclenchement du système de sécurité, des capteurs détectent la
décélération du véhicule : un signal électrique est envoyé à un détonateur, dans le générateur de gaz
de l'airbag. Une décomposition très rapide de l'azoture de sodium solide provoque la libération en
quelques milliseconde d'une quantité de gaz suffisante pour déployer le sac en polyamide du
coussin gonflable.
L'azoture de sodium NaN3 :
1 - Proposer une structure de Lewis de l'ion azoture N3-. Proposer une molécule et un ion
isoélectroniques de N3-.
3/9

2 - Proposer pour chaque espèce une structure de Lewis en accord avec les longueurs des liaisons et
discuter du caractère ionique de la liaison X-N.
azoture noté XN3longueur (ppm) de la liaison XN--NN longueur (ppm) de la liaison
XNN--N
HN3124 113
CH3N3124 110
NaN3115 115
3 - Une méthode de synthèse de l'azoture de sodium consiste à mélanger de l'amidure de sodium et
du nitrate de sodium à 175°C.
3NaNH2 + NaNO3 ---> NaN3 + 3NaOH + NH3.
- Calculer le nombre d'oxydation moyen de l'élément azote dans chaque espèce azotée.
- Comment peut-on qualifier cette transformation ? Préciser le(s) rôle(s) de l'amidure de sodium.
On donne les solubilités dans l'eau ( mol/L) à différentes températures :
T=298 K T=373 K
NaNO35,5 7,0
NaN34,3 5,5
NaOH 27,2 78,2
4 - Proposer des conditions de synthèse ( en termes de proportions de réactifs) permettant une
purification de l'azoture de sodium solide formé. Quel nom porte cette méthode de purification ?
La chimie dans l'airbag :
Trois réactions se produisent suite à l'amorçage du détonateur :2NaN3 ---> 2 Na + 3 N2 (1)
10 Na + 2KNO3 ---> K2O+5Na2O+N2 (2)
K2O+Na2O + SiO2 ---> K2Na2SiO4 poudre de verre amorphe (3)
Toutes les espèces sont solides sauf le diazote.
1 - Un coussin gonflable a un volume de 35 à 70 L pour le côté conducteur et de 60 à 160 L pour le
côté passager.
- Quelle quantité minimale d'azoture de sodium est nécessaire au gonflement d'un sac de 70 L à 300
K et sous 1 bar ?
- Le dispositif chimique actuellement utilisé peut être comparé à un dispositif de simple libération
du gaz qui serait sous pression dans le réservoir. Évaluer l'ordre de grandeur de la pression à
laquelle il faudrait comprimer, dans un réservoir de 500 mL; la quantité de diazote nécessaire au
gonflement du sac de 70 L sous 1 bar à 300 K.
Données : Masse volumique de l'azoture de sodium µ=1,85 g/mL.
2 - Conclure quand à l'intérêt d'utiliser un dispositif chimique plutôt qu'un dispositif de libération
d'un gaz sous pression. Justifier l'intérêt de provoquer les réactions (2) et (3) après explosion de
l'azoture. 4/9

Exercice III - Chimie organique : organomagnésiens
1 - Généralités
- La découverte des organomagnésiens a valu à leur inventeur le Prix Nobel de chimie en 1912.
Quel est le nom de ce chimiste français ?
- A partir de quels réactifs s’effectue la synthèse d’un organomagnésien ?
- Proposer, en le justifiant, un solvant pour cette synthèse (un seul critère est exigé).
- La synthèse d’un organomagnésien s’effectue dans un tricol surmonté d’un réfrigérant.
Quel est le rôle de ce réfrigérant ?
2 - Applications
La synthèse suivante illustre le grand intérêt des organomagnésiens en synthèse organique. Il s’agit
de la synthèse au laboratoire d’un sesquiterpène (molécule odorante en C15) : le calacorène, qui est
présent dans le clou de girofle notamment.
M1 est le calacorène. 5/9
 6
6
 7
7
 8
8
 9
9
1
/
9
100%