Quels examens pour ce sein

DOSSIER
14
La Lettre du Sénologue - n° 20 - avril/mai/juin 2003
d’apporter des données sur la bénignité ou la malignité. Le
Doppler couleur n’accroît pas la spécificité de l’examen.
– La mammographie n’est pas recommandée, car sa sensibilité
et sa spécificité sont faibles dans cette tranche d’âge et que l’on
n’observe que très rarement un carcinome canalaire avant 20 ans.
La lecture est en général difficile en raison de la densité des
glandes, encore que certaines jeunes filles présentent des glandes
en involution adipeuse assez marquée. On ne pratiquera un cliché
(par exemple, oblique externe qui déroule toute la glande) que
devant un examen clinique ambigu (placard irrégulier sensible),
ou devant une masse importante (à la recherche d’un hamartome
responsable d’une asymétrie mammaire, qui sera mieux mis en
évidence sur la mammographie que sur l’échographie), ou lors
d’un risque de cancer mammaire élevé. L’irradiation doit être
limitée : la radiosensibilité de la glande est très forte de 0 à 19 ans,
chute de 20 à 29 ans, puis reste stable (2).
examen clinique mammaire est primordial (1).
Les examens radiologiques sont employés de
façon différente chez la femme de plus ou de
moins de 30 ans, et certaines questions sont encore sans réponse
validée : notamment quant à la nécessité d’une mammographie
avant 30 ans et à la place des gestes interventionnels.
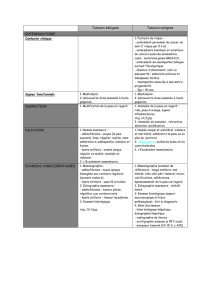
LES EXAMENS COMPLÉMENTAIRES
– L’échographie est, à cet âge, l’examen de première intention.
Elle sera pratiquée avec une sonde à très haute fréquence, indis-
pensable à l’heure actuelle car permettant une meilleure carac-
térisation des lésions tumorales. L’échographie a pour rôle
majeur de différencier une masse solide d’une masse liquidienne ;
elle est rarement utilisée ici comme un examen susceptible
Quels examens pour ce sein ?
●M. Boisserie-Lacroix*
* Hôpital Saint-André, CHU, Bordeaux.
L’

–La ponction cytologique a un intérêt réduit. L’aspect écho-
clinique est en général suffisamment évocateur. La ponction à
l’aiguille peut être utile pour vider un kyste, mais son rôle n’est pas
bien défini puisqu’il y a peu de lésions restant ambiguës après
un examen échographique à haute fréquence. Vetto a montré
que, lors d’antécédents familiaux ou en cas de doute, le triplet
diagnostique modifié (examen clinique, échographie mammaire
à la place de la mammographie et ponction cytologique) a, chez
l’adolescente et la jeune femme, une valeur prédictive négative
de cancer de 100 % quand tous ces éléments sont bénins et
concordants (3). Mais il faut savoir aussi que, chez les femmes
de moins de 30 ans, le taux de faux positifs de la ponction à
l’aiguille fine est plus élevé (4).
– La microbiopsie n’a pas été évaluée chez la très jeune femme.
La microbiopsie d’un nodule a priori bénin semble devoir être
évitée pour plusieurs raisons : s’il s’agit d’une masse volumi-
neuse ou d’un placard évoquant une papillomatose, l’exérèse
sera nécessaire et le geste interventionnel alors redondant ; le
diagnostic différentiel entre adénofibrome et phyllode n’est pas
possible sur une carotte de microbiopsie, la cellularité du stroma
étant difficile à apprécier sur un petit échantillon, et ce d’autant
qu’à cet âge les adénofibromes sont richement cellulaires. De
plus, ce geste paraît invasif et anxiogène chez une jeune fille. La
microbiopsie sera réservée aux cas exceptionnels de discordance
clinique et échographique : ainsi, les localisations de lymphomes
ont une présentation clinique orientant plutôt vers la bénignité,
alors que les signes échographiques sont plus ambigus.
– L’IRM ne permet pas la caractérisation d’une masse et n’a pas
d’indication sauf cas exceptionnel (appréciation de l’étendue et
des rapports d’une volumineuse tumeur, suivie d’une aénofibro-
matose dans des protocoles thérapeutiques).
CONDUITE DU DIAGNOSTIC EN PRATIQUE QUOTIDIENNE
Devant une mastodynie isolée
Devant une douleur mammaire, l’American College of Surgeons
recommande un examen clinique et une mammographie, sauf
chez les femmes de moins de 30-35 ans (en dehors de facteurs
de risque), et prônent l’échographie en première intention (5). On
peut discuter l’intérêt d’une échographie chez une très jeune fille.
Elle sera probablement normale, montrant un cône conjonctivo-
glandulaire hypoéchogène, occupant tout l’espace entre la peau
et le muscle pectoral. Pourquoi la pratiquer ? On a montré que
le “traitement” le plus efficace contre les douleurs mammaires
est l’exclusion d’une maladie sérieuse, la réassurance de l’image
corporelle et l’explication des douleurs ; on note alors une amé-
lioration ou une disparition des douleurs dans 85 % des cas. En
pratique, il faut reconnaître que l’échographie permet de rassurer
complètement la patiente et le médecin. C’est également ce qui
ressortait d’une enquête de A. Le Treut auprès de 195 généra-
listes ; 21,5 % des médecins interrogés prescrivaient un examen
radiologique chez les jeunes femmes de moins de 25 ans
présentant des mastodynies, “la sécurité de l’image apaisant
l’anxiété”, mais cette attitude ne doit pas devenir une règle (6).
Au moment de la puberté, la poussée du bourgeon mammaire
(stade S2 de Tanner) peut être responsable de mastodynie rétro-
aréolaire, et on palpe un nodule en arrière de l’aréole. L’examen
clinique est en général suffisant, mais, là encore, l’échographie
(figure 1) peut être prescrite dans un but de réassurance, jouant
le rôle du “miroir” qui fait prendre conscience à la fillette du
développement de sa poitrine.
Devant une asymétrie mammaire
Une petite différence de volume au cours du développement de
la poitrine est habituelle et en général s’estompe au stade S5 de
Tanner (sein adulte). Le sein le plus développé, tendu, peut être le
siège de mastodynies. Le recours à l’échographie est en général
inutile et ne doit être envisagé que pour calmer une inquiétude
trop vive.
Devant une hypertrophie mammaire
Lors d’hypertrophie juvénile (dans la période péripubertaire) ou
constitutionnelle (plus tardive), les seins sont fermes, sans masse
palpable compte tenu des limites de l’examen clinique dans les
glandes volumineuses. La mammographie standard est peu utile,
les glandes étant impénétrables ; l’échographie connaît des limites
étant donné la taille des seins. La mammographie numérisée et
l’imagerie par résonance magnétique nucléaire peuvent être
intéressantes pour éliminer un processus tumoral sous-jacent
(notamment un hamartome lorsque l’hypertrophie est asymétrique).
Devant un nodule palpable rétroaréolaire
L’échographie va permettre de trancher sur son caractère solide
ou liquidien. S’il apparaît transsonique pur ou avec un niveau
correspondant à des liquides de phases différentes, on évoquera
un kyste rétroaréolaire (figure 2). On examinera systématique-
ment le côté controlatéral à la recherche d’un kyste asympto-
matique. La ponction à titre diagnostique est inutile.
15
La Lettre du Sénologue - n° 20 - avril/mai/juin 2003
Figure 1. 12 ans. Mastodynies droites. Échographie: bourgeon mammaire.
Figure 2. 15 ans. Nodule rétroaréolaire droit sensible. Échographie :
kyste présentant une image de niveau.

Figure 4. 17 ans. Hypotrophie mammaire. Nodules palpables bilatéraux.
Adénofibromatose.
DOSSIER
16
La Lettre du Sénologue - n° 20 - avril/mai/juin 2003
Il est plus rare qu’un nodule rétroaréolaire apparaisse de contenu
solide à l’échographie, correspondant alors à un adénofibrome.
Quand le diagnostic hésite entre un adénofibrome et un kyste à
contenu épais, les sondes de très haute fréquence permettent une
meilleure approche de l’architecture interne, notamment en
mettant en évidence de petites fentes liquidiennes dans un adéno-
fibrome. Exceptionnellement, une petite tumeur rétroaréolaire
de type solide peut correspondre à un papillome (qui a été décrit
dans la littérature à partir de l’âge de 12 ans), en général associé
à un écoulement.
Devant un nodule palpable parenchymateux
Pour Cady (5), la mammographie ne devrait pas être réalisée en
première intention chez la femme de moins de 30 ans sauf dans le
cas d’antécédents familiaux ou de nodule d’emblée cliniquement
suspect (dur, non mobile). Le peu d’information qu’apporte la
mammographie est souligné dans les quelques autres publications
relevées dans la littérature, du fait de la densité des glandes, et
limité à la recherche d’images telles que discrète distorsion archi-
tecturale ou microcalcifications de mastopathie fibrokystique.
Tout nodule n’ayant pas disparu après les règles ou ne présentant
pas de modification liée au cycle menstruel doit faire pratiquer
une échographie. La découverte de kystes banals dans le cadre
d’une mastopathie fibrokystique est rare avant 20-24 ans, et leur
aspect échographique ne pose pas de problème diagnostique.
Une ponction évacuatrice sera réalisée si le kyste est douloureux.
Le nodule peut se révéler solide : les signes communs au syn-
drome tumoral bénin sont une forme ovalaire parallèle au plan
cutané, des contours nets avec ombres latérales, une échostructure
interne modérément hypoéchogène homogène, un renforcement
postérieur marqué, une dépressibilité sous la pression de la
sonde. Un nodule parenchymateux indolore mobile de moins de
3 cm se traduisant par un syndrome tumoral bénin correspond à
un adénofibrome (figure 3). Son siège est en général superficiel
et, chez la jeune fille, il présente souvent une échogénéicité élevée
et un renforcement postérieur marqué dus à sa forte cellularité
(7). Il n’y a pas à cet âge d’aspect atypique et de problème
diagnostique, d’autant que les sondes échographiques de très
haute fréquence offrent une meilleure analyse des lésions et ont
introduit de nouveaux critères échographiques plus fiables : visi-
bilité de fentes liquidiennes, de septa échogènes. On pourrait
évoquer aussi un adénome, beaucoup plus rare, certains en faisant
une entité différente de l’adénofibrome (prolifération de tubes
séparés par un stroma réduit) ; en pratique, les aspects radio-
cliniques et la conduite à tenir ne diffèrent pas de ceux de l’adéno-
fibrome.
Il est rare qu’une ponction soit nécessaire et encore moins une
microbiopsie (8). Un adénofibrome de 3 cm peut être surveillé
cliniquement et échographiquement. On peut proposer une écho-
graphie tous les six mois pendant deux ans pour ne pas mécon-
naître une tumeur phyllode ; mais il est souhaitable de ne pas
être anxiogène, et, à cet âge, la compliance à un suivi est moindre
qu’à l’âge adulte (9). L’adénofibrome peut disparaître sponta-
nément, notamment avant l’âge de 20 ans (10). L’indication chi-
rurgicale sera portée devant un nodule de taille supérieure à 3 à
4 cm, ou douloureux, ou selon le choix de la jeune patiente et des
parents. La voie périaréolaire sera choisie si possible (11), et on
se devra de prévenir l’apparition possible d’autres adénofibromes.
L’exérèse chirurgicale des adénofibromes représente 75 % des
biopsies mammaires avant l’âge de 20 ans (12).
Devant des nodules multiples évoquant une adénofibromatose
La conduite à tenir est difficile devant des nodules multiples uni-
ou bilatéraux, qui s’observent dans 10 à 20 % des cas, de façon
synchrone ou successive, particulièrement chez les jeunes filles
de race noire (figure 4). L’enjeu de la surveillance est d’éviter
des interventions itératives. Un nodule gênant de 4 à 5 cm sera
en pratique enlevé, dans la crainte d’une tumeur phyllode (9). Il
est parfois difficile de comptabiliser à l’échographie des nodules
trop nombreux, et certains auteurs proposent un suivi par IRM
chez les jeunes femmes sous traitement antihormonal (13).
Le syndrome tumoral d’évolution rapide
Il est difficile, au vu de l’examen clinique, d’affirmer une étio-
logie devant une masse de plus de 4 à 5 cm, responsable de
troubles trophiques (14).
Figure 3. 17 ans. Nodule palpable mobile indolore. Échographie :
lacune de 15 mm présentant des critères de bénignité (discrète hypo-
échogénicité, macrolobulations antérieures). Surveillance à 6 mois, puis
1 an : régression du nodule (10 mm).

Assez caractéristique avant 20 ans est la poussée évolutive
d’un adénofibrome appelé “géant” quand il dépasse 5 cm (15).
L’hétérogénéité à l’échographie est fréquente, avec des zones
liquidiennes de nécrose spontanée, alors que cette nécrose est
rare dans les adénofibromes de la femme adulte. Il existe des
bandes échogènes intratumorales correspondant aux bandes
collagènes entre les lobules (figure 5).
Aucun signe, ni clinique ni radiologique, ne permet de trancher
avec une tumeur phyllode. Un aspect échographique évocateur
est la présence de zones liquidiennes intratumorales, périphé-
riques, de 3 à 10 mm (16). L’IRM ne permet pas la caractérisation
d’une masse avec certitude, même si des septa intratumoraux
sont plutôt en faveur d’un adénofibrome (13).
On peut discuter un hamartome (plus rare que l’adénofibrome).
La consistance en est plus molle. On l’évoquera surtout devant
une asymétrie mammaire d’apparition récente. Un cliché mammo-
graphique est alors intéressant à pratiquer, montrant typique-
ment une image mixte claire et opaque ; mais, si la composante
conjonctive est prédominante, il s’agira d’une volumineuse
opacité ronde régulière.
L’hypothèse d’un sarcome doit être évoquée, même si ce cas de
figure est exceptionnel.
Quelle que soit l’hypothèse diagnostique, la taille de la tumeur
et son retentissement trophique imposent une exérèse. Une
microbiopsie serait redondante.
Devant un placard sensible ou un nodule
ayant les caractéristiques d’un adénofibrome, l’échographie peut
parfois montrer une plage hypoéchogène plus ou moins bien
limitée, comportant de petits kystes périphériques (17). L’aspect
évoque alors une papillomatose juvénile, spécifique de la jeune
fille. On peut même visualiser des végétations à l’intérieur des
kystes (figure 6). Cependant, avec les sondes à haute fréquence,
on observe de plus en plus souvent des petits kystes groupés, et le
diagnostic ne doit pas être abusivement porté ; on se souviendra
qu’il n’a pas été décrit dans la littérature de papillomatose
asymptomatique, compte tenu du petit nombre de cas que com-
portent les quelques séries connues. Cette masse ambiguë doit
faire pratiquer au moins un cliché mammographique, révélant
parfois des nodules confluents ou une désorganisation architec-
turale et, dans 3 cas sur 4, des microcalcifications irrégulières
(17). La mammographie peut être négative quand le conjonctif
est trop dense. Si le diagnostic est hésitant, la sanction étant
chirurgicale, il peut être intéressant, dans ce cas, de pratiquer
une ponction cytologique, voire une microbiopsie afin d’exclure
une métaplasie. Les rapports entre papillomatose et cancer ne
sont pas établis. On n’a pas de suivi à long terme des quelques
cas recensés. Les patientes n’auraient pas de risque particulier
de développer un cancer du sein avant 30 ans. Le rôle du clini-
cien restera difficile, tant que le potentiel évolutif de cette lésion
ne sera pas établi, et il est n’est pas possible de proposer un
schéma de surveillance radiologique.
L’aspect échographique du placard palpable peut être ambigu
(hypoéchogène, mal délimité). Il faut savoir que c’est justement
chez la jeune femme que s’observent les formes pseudo-tumorales
de mastopathie fibrokystique (18) avec masse palpable et tra-
duction radiologique suspecte. Quelques cas de cicatrice radiaire
chez des jeunes filles de 20 ou 21 ans ont été rapportés (19). On
sait que les critères mammographiques de bénignité des images
stellaires sont aléatoires. La valeur prédictive positive de mali-
gnité de telles images est moindre que chez la femme adulte,
puisque l’incidence du cancer est plus basse. La microbiopsie
ne doit pas être pratiquée devant des images stellaires ou des
placards hétérogènes, c’est toute la lésion qui doit être analysée.
Dans un contexte traumatique
Si le nodule palpable apparaît de type liquidien, parfois cloisonné
ou hétérogène en fonction de l’évolution, on évoquera un héma-
tome. Un tel aspect dans le contexte clinique – en s’assurant
qu’il y a bien eu un choc – est suffisant pour poser le diagnostic.
Devant un syndrome inflammatoire
L’ectasie canalaire a été décrite chez la très jeune femme, respon-
sable parfois de douleurs rétro-aréolaires à type de picotement.
17
La Lettre du Sénologue - n° 20 - avril/mai/juin 2003
Figure 5. 23 ans. Masse mobile augmentant de volume rapidement.
Échographie : syndrome tumoral bénin, visibilité de septa échogènes.
Exérèse chirurgicale : adénofibrome.
Figure 6. 19 ans. Placard sensible supéro-externe droit. Échographie :
kyste présentant un épaississement irrégulier de paroi. Exérèse chirurgi-
cale : papillomatose juvénile.

DOSSIER
Figure 8. 19 ans. Maladie de Cowden (ou des hamartomes multiples,
avec risque relatif élevé de cancer du sein dès l’âge de 20 ans).
Mammographie : images mixtes (claires et opaques) correspondant aux
hamartomes.
18
La Lettre du Sénologue - n° 20 - avril/mai/juin 2003
Des nodules peuvent être palpés, correspondant à des kystes
galactophoriques ; l’échographie montre alors des canaux dilatés,
remplis de sécrétions hyperéchogènes, à ne pas confondre avec
des lésions solides intracanalaires hypoéchogènes et arrondies.
L’abcès centromammaire, comme chez la femme adulte, survient
souvent sur ectasie canalaire. L’abcès superficiel ou para-aréolaire
est dû à l’infection récidivante de la partie proximale d’un canal
galactophorique, qui se rompt à la jonction peau-aréole, zone de
moindre résistance. L’échographie est le seul examen à réaliser,
en première intention, comme chez la femme adulte (figure 7).
Mais la démarche diagnostique n’est pas sous-tendue par la
hantise du cancer inflammatoire, et on peut être totalement
rassuré par la disparition des signes cliniques. L’aspect est celui
d’une collection, anéchogène à contours irréguliers ; parfois, le
pus crée un aspect de sédimentation avec niveau. Dans l’abcès
périaréolaire, on peut suivre le canal dilaté sous la peau (14).
L’échographie de contrôle après 15 jours de traitement est
nécessaire.
EXAMENS RADIOLOGIQUES
DANS UN CONTEXTE CANCÉROLOGIQUE
Le risque de cancer héréditaire
Le rapport de l’expertise collective INSERM (20) a précisé les
modalités du dépistage des très jeunes femmes génétiquement
prédisposées (chez lesquelles on a trouvé une mutation génique
de BRCA 1 ou 2et exposées à un risque de développer un cancer
d’au moins 20 %). On recommande un examen clinique deux à
trois fois par an dès l’âge de 20 ans. En se fondant sur l’opinion
d’experts concernant le bénéfice présumé du dépistage mammo-
graphique, le rapport INSERM le recommande à partir de l’âge
de 30 ans, voire plus tôt en fonction du contexte familial et indi-
viduel (cinq ans avant l’âge de survenue du cancer le plus pré-
coce dans la famille) (figure 8). Ce dépistage comprendra deux
incidences, sera annuel, avec une double lecture, en limitant la
dose délivrée par un contrôle de qualité rigoureux. Ces jeunes
femmes ont donc un dépistage personnalisé, hors programme de
dépistage organisé. Des protocoles sont en cours pour évaluer le
rôle de l’IRM dans le dépistage (21). On recommande égale-
ment une mammographie avant une grossesse et dans les six
mois du post-partum (22).
Les effets carcinogènes des rayons X
Le bénéfice du dépistage doit compenser le risque hypothétique
mais probable de cancer radio-induit. Les effets carcinogènes
des rayons X ont été appréciés par le suivi à long terme des ado-
lescentes ayant eu des radioscopies pour tuberculose ou scoliose
rachidienne.
Chez les femmes atteintes du syndrome héréditaire de Li-Fraumeni,
la survenue du cancer est particulièrement précoce et incite à
débuter très tôt le dépistage ; mais dans ce syndrome, la radio-
sensibilité cellulaire est accrue, et les radiations ionisantes
peuvent accélérer le processus cancéreux.
Toutefois, si l’hypersensibilité aux RX des femmes porteuses de
mutations BRCA n’est pas démontrée, elle est possible. Il reste
prudent de ne pas commencer la surveillance mammographique
trop tôt et de limiter le nombre d’incidences et la dose délivrée
(20).
Les cancers radio-induits
Ils ont été décrits initialement chez les femmes exposées aux
bombes atomiques. Plusieurs équipes étudient actuellement la
survenue d’un cancer du sein chez les femmes traitées par irra-
diation en mantelet pour maladie de Hodgkin. La plupart des
cancers apparaissent à l’intérieur du champ d’irradiation ou en
bordure. Le risque relatif est d’autant plus augmenté que l’irra-
diation a eu lieu avant 20 ans (20). Tous âges à l’irradiation
confondus, la série la plus récente (23) trouve un risque relatif
global de 10,6 particulièrement élevé chez les jeunes filles irra-
diées entre 10 et 19 ans. Peut-être aussi la maladie de Hodgkin
prédispose-t-elle aux cancers secondaires, la radiothérapie et
chimiothérapie agissant en synergie. Des facteurs génétiques de
susceptibilité aux radiations interviennent aussi.
Dans toutes les études, le cancer est survenu 10 à 15 ans après
l’irradiation, donc à un jeune âge (à partir de 16 ans). Il est
conseillé de pratiquer une mammographie annuelle huit à dix
ans après l’irradiation, une incidence couplée à une échographie
chez les femmes de moins de 30 ans aux glandes denses (24).
Figure 7. 21 ans. Syndrome inflammatoire périaréolaire droit. Écho-
graphie : canal dilaté à contenu épais et hétérogène. Abcès périaréolaire.
Disparition sous antibiothérapie.
 6
6
1
/
6
100%