voies doul iade v2

VOIES DE TRANSMISSION ET MÉCANISMES DE CONTRÔLE
DE LA DOULEUR DEFINIR LA DOULEUR
Douleur: expérience multidimensionnelle
Douleur: « expérience sensorielle et émotionnelle désagréable,
associée à une lésion tissulaire réelle ou potentielle, ou décrite en
ces termes ». (IASP)
La nociception concerne les mécanismes qui génèrent la douleur
en réponse à une stimulus nociceptif ou décrit comme tel par les
sujets normaux.
Définition
intensité: moyenne, modérée, sévère
qualité: piqûre, brûlure,
durée: transitoire, intermittente, persistante
position (?): superficielle ou profonde, localisée ou diffuse
Discriminatif
Cognitif à l’origine des phénomènes comportementaux
Lié à l’expérience antérieure mémorisée
Emotionnel confère à le caractère désagréable
Description et compensantes
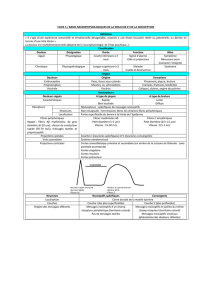
Cutaneous pain Muscular pain Visceral pain :
psychophysics Visceral pain :
neurobiology
Description Piqure, brûlure,
lancinant crampe
Localisation Locale, precise Locale, diffuse,
densité de
l’innervation entre la
peau et les viscères
Diffuse, peu
localisée, profonde
dans le corps
Peu d’afférences
viscérales, grande
divergence dans la
distribution
Douleur référée non Oui, au niveau des
tissus somatiques
profonds: muscle,
fascia, tendons,
joints, ligaments
Oui, au niveau de la
peau Convergence
viscéro-somatique
dans les voies
centrales
stimulations Toutes stimulations Toutes stimulations Pas liée à une
lésion, pas à partir
de toute les viscères
Distension et
ischémie
Différences entre tissu cutané et autres tissus
Woolf, 2004
Différentes manières de classer les douleurs
aiguë/chronique
transitoire/réversible/irréversible
= Adaptée/non adaptée

CONSEQUENCES CLINIQUES DE LA DOULEUR AIGUE Conséquences sur la morbimortalité
Randomised trial of fentanyl anaesthesia in preterm babies
undergoing surger y: effects on the stress response.
Anand et al Lancet. 1987;1:62-6.
Essai controlé randomisé - Prématurés : ligature du canal artériel
Sous AG AVEC FENTANYL (n = 8) vs SANS FENTANYL (n = 8)
1 - Réponses hormonales majeures
(taux plasmatiques de adrenaline,
noradrenaline, glucagon, aldosterone, corticosterone, etc …)
Significativement plus importantes dans le groupe sans fentanyl
2 - Complications circulatoires et métaboliques postopératoires
dans Gr sans Fentanyl.
“La réponse au stress chirurgical est prévenue par le Fentanyl ce qui améliore
les suites postopératoires chez le prématuré”.
Epidural analgesia improves outcome after multiple rib fractures
Eileen M et al Surgery 2004;136:426-30
Traumatisme thoracique avec plus de 3 cotes fracturées:
Analgésie péridurale vs morphine systémique
Ajustement
sur lésion pulmonaire
247 décès dans les 30 jours.
1/3 de moins dans le groupe
Anesthésie médullaire
OR = 0.7 [0.54 – 0.90]
I - Mortalité totale
Diagnostics:
45% : EP, évènements cardiaque ou AVC,
31%: Causes infectieuses
24%: autres causes.
II- Morbidité

Modification de la perception douloureuse:
Augmentation de la perception de la douleur
Douleur chronique
Les scores de douleurs lors de la vaccination
sont plus élevés chez les enfants Placebo.
Effect of neonatal circumcision on pain response during
subsequent routine vaccination.
Taddio et al. Lancet 1997 ; 349 : 599-603.
Circoncision : EMLA versus Placebo
Impact sur la douleur provoquée par une
vaccination ultérieure
Analgésie périopératoire et douleur chronique
Prévalence de la douleur chronique postopératoire :
Reuben et al Reg Anesth Pain Med 2006:
AINS périopératoire
=> Réduction l’incidence de la douleur chronique au site
de prise de greffon osseux de 30 à 10%
Obata et al Can J Anaesth 1999:
Analgésie peridurale postopératoire vs morphine systémique
après thoracotomie
=> Réduction l’incidence de la douleur chronique de 67 à 23%
« REHABILITATION »
Effects of perioperative analgesic technique on the surgical
outcome and duration of rehabilitation after major knee
surgery.
Capdevila et al Anesthesiology 1999; 91:8-15
ALR vs Morphine systémique après chirurgie du genou:
1 => Diminution significative de l’EVA
2 => Réduction de la durée en centre de rééducation:
50 j (Morphine) vs 37 j (ALR) (p<0,05)
Conclusion: « L’ALR améliore la rééducation précoce par un
contrôle efficace de la douleur »
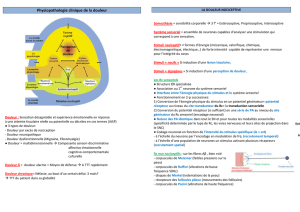
Quelques rappels anatomiques

Si douleur aiguë: système nociceptif activé
périphérie moelle épinière tronc cérébral thalamus
cortex cérébral
Permet d’éviter les lésions tissulaires par un comportement adapté
Système d’alerte
Sensation physiologique vitale
Si lésion tissulaire: l’organisme favorise la cicatrisation (inflammation)
Si lésion du système nerveux: douleur neuropathique
Si pas de déficit neurologique ou d’anormalité périphérique:
douleur « fonctionnelle » (migraine)
Dans ces 3 derniers cas:
• douleur peut survenir lors d’un stimulus normalement non
douloureux (allodynie)
• douleur prolongée et exagérée lors d’un stimulus
douloureux (hyperalgésie)
On peut aboutir à des douleurs sans stimulus périphérique
Système Nerveux Central
SNC
Le système nerveux
Encéphale
Moelle épinière
Système nerveux Périphérique
SNP
Ensemble de
NERFS
constituant le
système nerveux
périphérique
+
SYSTEME NERVEUX
Système Nerveux
central Système nerveux
périphérique
Système Nerveux
SOMATIQUE Système Nerveux
AUTONOME ou VÉGÉTATIF
Réponse contrôlable aux informations
sensorielles externes par un mouvement
adapté à l’environnement
Réponse incontrôlable aux informations sensorielles
internes pour réguler des fonctions vitales : digestion,
respiration, circulation sanguine, sécrétion d’hormone
Le système nerveux
Système Nerveux
Central Système nerveux
Périphérique
Système Nerveux
Somatique Système Nerveux
Autonome
Système Nerveux
SYMPATIQUE Système Nerveux
PARASYMPATIQUE
Situation d’alerte
dilatation des bronches,
accélèration de FC et FR
dilatation pupillaire,
augmente la sudation et la PA,
mais diminue l'activité digestive.
associé à l'activité de deux neurotransmetteurs
: noradrénaline et adrénaline.
Situation normale
ralentissement général des fonctions de
l'organisme afin de conserver l'énergie.
Réactions inverse au SNS.
favorise la fonction digestive et l'appétit sexuel
associé à un neurotransmetteur: l’acétylcholine.
Lobe
pariétal
Lobe
temporal
Sillon de Rolando
= sillon central
Sillon
parieto-occipital
Scissure
de Sylvius
Le Cortex est divisé en lobes
Incisure
temporo-occipitale
Lobe
occipital
Lobe
frontal

Aire
somesthésique
Aire motrice
Aire visuelle
Aire motrice
du langage
Aire auditive
Aire olfactive
(sous le lobe temporal)
Aire de Broca
articulation Aire de Wernicke
compréhension
Divisions fonctionnelles du cortex
En blanc = aires associatives
Variabilité de l'épaisseur relative des différentes couches corticales
Aires sensorielles Aires associatives Aires motrices
Couche I
Couche II
Couche III
Couche IV
Couche V
Couche VI
Organisation somatotopique du néocortex
La surface dévolue à chaque organe
correspond à son degré de sensibilité ou de
motricité
Télencéphale Diencéphale
Thalamus
Structures diéncéphaliques
Télencéphale Diencéphale Mésencéphale
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%