François Barrière - Service Central d`Authentification Université de

UNIVERSITE DE NANTES
FACULTE DE MEDECINE
Année 2011 N°
THESE
pour le
DIPLOME D’ETAT DE DOCTEUR EN MEDECINE
DES DE PEDIATRIE
par
François Barrière
né le 8 juillet 1983 à Nantes
Présentée et soutenue publiquement le 03 octobre 2011
LE LUPUS NEONATAL
EVALUATION DE LA PRISE EN CHARGE DU RISQUE
CARDIOLOGIQUE AU CHU DE NANTES
Présidente : Madame le Professeur Véronique GOURNAY
Directrice de thèse : Docteur Emma ALLAIN-LAUNAY

Liste des abréviations
- BAVc : Bloc Auriculo-Ventriculaire congénital
- SNFMI : Société Nationale Française de Médecine Interne
- ECG : Electrocardiogramme
- SA : Semaines d’Aménorrhée
- NFS : Numération Formule Sanguine
- ASAT : Aspartate Amino Transférase
- ALAT : Alanine Amino Transférase
- GGT : Gamma Glutamyl Transpeptidase
- PMSI : Programme de Médicalisation des Systèmes d’Information
- FCS : Fausse Couche Spontanée
- IVG : Interruption Volontaire de Grossesse
- IMG : Interruption Médicale de Grossesse
- MFIU : Mort Fœtale In Utero
- AAN : Anticorps Anti-Nucléaires
- HTA : Hypertension artérielle
- PM : Pacemaker
- CMG : Cardiomégalie
- QTc : QT corrigé
- SAPL : Syndrome des anti-phospholipides
- IEC : Inhibiteur de l’enzyme de conversion de l’angiotensine
- ELISA : Enzyme Linked ImmunoSorbent Assay

3
I. SOMMAIRE
I. SOMMAIRE .................................................................................................. 3
II. INTRODUCTION ............................................................................................ 5
III. GENERALITES SUR LE LUPUS NEONATAL ...................................................... 7
1) Historique ........................................................................................................................ 7
2) Epidémiologie et prévalence ........................................................................................... 8
3) Manifestations clinico-biologiques du lupus néonatal ................................................... 9
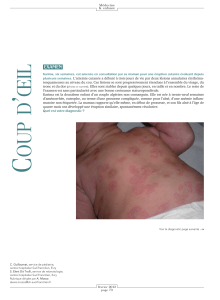
Manifestations cutanées ......................................................................................................... 9
Manifestations cardiaques .................................................................................................... 11
Manifestations biologiques ................................................................................................... 15
Autres manifestations ........................................................................................................... 16
4) Proposition de prise en charge des grossesses « à risque » ......................................... 17
IV. ETUDE RETROSPECTIVE AU CHU DE NANTES ............................................. 18
1) Introduction ................................................................................................................... 18
2) Matériels et méthodes .................................................................................................. 19
Femmes « à risque ».............................................................................................................. 19
Femmes asymptomatiques ................................................................................................... 19
Nouveau-nés « à risque » ...................................................................................................... 20
Résumés des situations cliniques en cas de BAVc ................................................................. 20
3) Résultats ........................................................................................................................ 21
Diagramme de flux ................................................................................................................ 21
Données globales .................................................................................................................. 22
Femmes « à risque ».............................................................................................................. 23
Femmes asymptomatiques ................................................................................................... 26

4
Nouveau-nés « à risque » ...................................................................................................... 26
Résumés des situations cliniques en cas de BAVc ................................................................. 30
V. DISCUSSION ET PERSPECTIVES ................................................................... 37
1) Evolution de la prise en charge des grossesses « à risque » ......................................... 38
Epidémiologie du lupus néonatal .......................................................................................... 38
Suivi échographique et intérêt du PR mécanique ................................................................. 39
Intérêt du taux d’anticorps maternels .................................................................................. 41
Vers un traitement préventif du BAVc .................................................................................. 43
2) Devenir des femmes asymptomatiques........................................................................ 44
3) Prise en charge des nouveau-nés « à risque » .............................................................. 45
4) Prise en charge en cas de BAVc ..................................................................................... 46
5) Propositions de suivi au CHU de Nantes ....................................................................... 49
VI. CONCLUSION.............................................................................................. 51
VII. ANNEXES .................................................................................................... 52
Figure 1 .................................................................................................................................. 52
Figure 2 .................................................................................................................................. 52
Figure 3 .................................................................................................................................. 53
Figure 4 .................................................................................................................................. 53
Figure 5 .................................................................................................................................. 54
Figure 6 .................................................................................................................................. 54
Figure 7 .................................................................................................................................. 55
Figure 8 .................................................................................................................................. 56
Figure 9 .................................................................................................................................. 56
Figure 10 ................................................................................................................................ 57
Annexe 1 ................................................................................................................................ 58
Annexe 2 ................................................................................................................................ 59
VIII. REFERENCES BIBLIOGRAPHIQUES ........................................................ 60

5
II. INTRODUCTION
Le lupus néonatal est un syndrome rare pouvant atteindre les fœtus et nouveau-nés de
mères porteuses d’anticorps anti SSA/Ro et/ou anti SSB/La. Ces anticorps peuvent être
présents chez des mères totalement asymptomatiques ou s’intégrer dans un tableau de lupus,
un syndrome de Gougerot-Sjögren ou d’autres maladies dysimmunitaires [1-3].
Il s’agit d’une affection auto-immune acquise « passive » secondaire au passage
transplacentaire d’anticorps maternels vers le fœtus [4]. Il peut être responsable de
manifestations systémiques transitoires (atteinte cutanée, hématologique ou hépatique) ou
permanentes comme le bloc auriculo-ventriculaire congénital (BAVc) survenant sur cœur
sain, et faisant toute la gravité de ce syndrome [5, 6].
Le terme de lupus néonatal a été retenu compte tenu de la similitude des lésions
cutanées avec celles observées en cas de lupus systémique.
Nous décrirons dans une première partie l’historique et l’épidémiologie du lupus
néonatal, ses manifestations clinico-biologiques ainsi que les propositions de prise en charge
des grossesses « à risque » de lupus néonatal en France instituées par la Société Nationale
Française de Médecine Interne (SNFMI) depuis la réalisation d’un registre français des
grossesses avec anticorps anti SSA/Ro.
Dans une deuxième partie, nous nous intéresserons à l’évaluation de la prise en charge
du risque cardiologique de lupus néonatal au CHU de Nantes sur les dix dernières années à
l’aide d’une étude rétrospective réalisée en collaboration avec les services de gynécologie
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
1
/
68
100%