TP TITRE

TP : SYNTHESE DE L'ASPIRINE
+CH3CO
O
CCH3O
+CH3COOH
OH
COOH
O CO CH3
COOH
=
acide salicylique anhydride acétique aspirine acide acétique
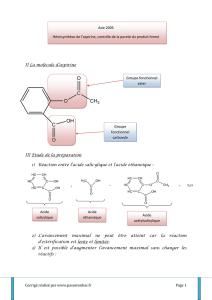
a) La réaction utilisée pour réaliser la synthèse de l’aspirine est une réaction de synthèse d’un ester (fabrication
d’un groupement ester)
b) Si on remplaçait l’anhydride acétique pour obtenir l’acide acétylsalicylique à partir de l’acide salicylique on
utiliserait acide éthanoïque :
c) L’avantage que présente la réaction avec l’anhydride acétique est que c’est une réaction totale.
d) L'intérêt du réfrigérant à eau, dans ce mode opératoire, est de permettre de chauffer le mélange réactionnel
(pour augmenter la vitesse de réaction) sans perdre de mélange réactionnel. Ce montage est le montage à
chauffage à reflux
e) Les moyens utilisés ici pour augmenter la vitesse de la réaction sont :
- Augmentation de la température du mélange réactionnel (on augmente l’agitation thermique et donc la
proportion des chocs efficaces sur l’ensemble de chocs entre molécules).
- Introduction d’un catalyseur : acide sulfurique concentrée.
f) Le schéma du dispositif utilisé :
g) On rince avec de l'eau glacée pour deux raisons :
L’acide acétylsalicylique est très peu soluble dans l’eau froide.
On doit éviter de réaliser l’hydrolyse de l’acide acétylsalicylique, ainsi le fait de rincer à l’eau glaçée permet
de stoppée cette réaction (on réalise une trempe).
h) On pourrait vérifier expérimentalement que les cristaux sont secs, en réalisant un test de présence de l’eau (en
utilisant du sulfate de cuivre anhydre).
i) Lorsqu'on ajoute de l'eau par le sommet du réfrigérant il se produit une réaction d’hydrolyse de l’anhydride
acétique :
CH3 -C
O
OH
Supports
Chauffe-Ballon
Ballon à
fond rond
Réfrigérant
à boules
5,00 g d’acide salicylique
10 mL d’anhydride acétique
quelques gouttes d’acide sulfurique concentré
quelques grains de pierre ponce.
CH3 -C
O
O
CH3 -C
O
+ H2O = 2
CH3 -C
O
OH

j) Etablissons un tableau d'avancement.
Soit n1 la quantité de matière initiale d’acide salicylique :
n1 = m1 / M(acide salicylique)
n1 = 5,00 / 138
n1 = 3,62.10-2 mol
Soit n2 la quantité de matière initiale d’anhydride acétique :
m2 = (anhydride acétique).V avec (anhydride acétique) = 1,05 kg.L-1 = 1,05 g.mL-1
m2 = 1,05 x 10
m2 = 11 g (arrondi par excès pour respecter les C.S.)
n2 = m2 / M(anhydride acétique)
n2 = 11 / 102
n2 = 1,1.10-1 mol
Si la réaction est totale (c’est le cas)
Si l’acide salicylique est limitant :
3,62.10-2 – Xmax = 0 Xmax = 3,62.10-2 mol
Si l’anhydride acétique est limitant :
1,1.10-1 – 2.Xmax = 0 Xmax = 5,5.10-2 mol
Donc le réactif limitant est l’acide salicylique est le réactif limitant et Xmax = 3,62.10-2 mol
k) La masse maximale d'aspirine théoriquement formée est :
mth(aspirine) = nf(aspirine).M(aspirine)
mth(aspirine) = Xmax.M(aspirine)
mth(aspirine) = 3,62.10-2 x 180
mth(aspirine) = 6,5 g
On peut en déduire le rendement de la synthèse. Pour cela, nous allons considérer que le solide obtenue est
constitué à 100 % d’aspirine (ce qui n’est pas exactement le cas, nous le verrons par la suite) et que nous n’avons
rien perdu dans nos différentes manipulations :
On rappel que le rendement de l'estérification est le rapport entre la quantité de matière d'ester effectivement
obtenue nef et la quantité de matière d'ester que l'on obtiendrait si la réaction était totale nf(aspirine) = Xmax
)(aspirinen
n
f
ef
max
X
nef
Or
nef = mef / M(aspirine) avec mef la masse effectivement obtenue d’aspirine ici mef = 1,27 g
nef = 1,27 / 180
nef = 7,06.10-3 mol
Ainsi
2
3
max 10.62,3 10.06,7
X
nef
%5,19
Réactifs Produits
+CH3CO
O
CCH3O
+CH3COOH
OH
COOH
O CO CH3
COOH
=
Etat du
système
Avancement
(en mol)
Mol d’acide
salicylique
Mol d‘
anhydride
acétique
Mol d’
aspirine
Mol d’acide
acétique
Etat initial
X = 0
3,62.10-2
1,1.10-1
0
0
Au cours de la
transformation
X
3,62.10-2 – X
1,1.10-1 – 2.X
X
2.X
1
/
2
100%