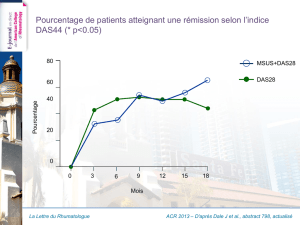
La Suppression génétique de la toxicité de la polyglutamine

La Suppression génétique de la toxicité de la
polyglutamine chez Drosophila
Parsa Kazemi-Esfarjani, * Seymour Benzer
Un model de Drosophila pour la maladie de Huntington et d’autres maladies
polyglutaminiques a été utilisé pour observer des facteurs génétiques qui modifient la
dégénérescence causée par l’expression de la polyglutamine dans l’œil. Parmi 7000 insertions
d’éléments P, plusieurs brins suppresseurs ont été isolés, deux d’entre eux menèrent à la
découverte de gènes suppresseurs décrits ici. Le produit prévu d'un, dHDJ1, est homologue à
la protéine humaine 40/HDJ1 de choc thermique. Celui du deuxième, dTPR2, est homologue
à la protéine humaine de répétition de tetratricopeptide 2. Chacune de ces molécules contient
un domaine chaperon-connexe J. Leur suppression de la toxicité de polyglutamine a été
vérifiée dans les mouches transgéniques.
Division of Biology, California Institute of Technology, Pasadena, CA 91125, USA.
* To whom correspondence should be addressed. E-mail: [email protected]
Des régions augmentées de polyCAG dans les gènes pour la maladie de Huntington (HD) et
au moins sept autres désordres sont associées à la neurodégénérescence héréditaire (1). Les
polyCAGs sont traduits en polyglutamines, qui forment les agrégats cytoplasmiques et/ou
nucléaires et produisent les effets toxiques (1, 2). Une approche de l'identification des
protéines qui peut modifier l'agrégation et la toxicité de polyglutamine est l'isolement de
l’enhancer et des gènes suppresseurs. À cette fin, l'œil de drosophile offre un système de
modèle sensible (3, 4). Dans une approche de gènes candidats, p35, un gène antiapoptotique
de baculovirus, et une protéine humaine de choc thermique (HSP70, codé par le gène de
HSPA1L) ont supprimé la dégénérescence polyglutamine-dépendante dans l'œil (3, 5). Ici une
approche alternative est décrite : examinant le génome de mouche pour les gènes qui
modifient de façon dominante la toxicité de la polyglutamine.
En suivant une méthode de réaction par amplification en chaîne (PCR), nous avons synthétisé
des polyCAGs de courte longueur (20 CAGs) et de longueur augmentée (127 CAGs) (6).
Ceux-ci ont été placés en cis dans les constructions transgéniques, en amont par rapport à la
séquence activatrice UAS de levure. Leur expression a été activée dans des croisements
génétiques en trans du facteur de transcription de la levure GAL4, expression qui
alternativement a été réglé par le promoteur spécifique de l’œil GMR en amont du cDNA de
la levure GAL4 (7-9). GMR se compose de cinq copies tandem d'un élément de réponse
dérivé du promoteur de gène de la rhodopsine 1, un accepteur pour facteur de transcription
spécifique de l’œil GLASS (10). Ce promoteur augmente l'expression du gène rapporteur
dans tous les types rétiniens de cellules pendant qu'elles se développent. Des mouches portant
GMR-GAL4 ont été croisées avec trois lignées transgéniques indépendamment produites
d'UAS-polyCAG portant la répétition 20-CAG courte (UAS-20Q) et avec celles contenant la
répétition 127-CAG augmentée (UAS-127Q), et dans tous les cas ont été marqués avec une
séquence d'épitope de l’hémagglutinine (HA) (11).
Dans chacune des trois lignées de GMR-GAL4/UAS-20Q, les mouches ont éclos comme des
adultes avec les yeux qui étaient morphologiquement normaux et ont eu une distribution
normale de pigments. En revanche, les trois lignes de GMR-GAL4/UAS-127Q ont eu les

yeux sévèrement anormaux (Fig. 1). L’immunomarquage du marqueur HA de coupe
histologiques au cryostat de mouches GMR-GAL4/UAS-127Q montra les agrégats dans les
remnants de la rétine (12). On n'a observé aucune souillure dans les mouches GMR-
GAL4/UAS-20Q, probablement en raison d'un manque d'agrégation ou du renouvellement
rapide de la protéine plus courte. Les mouches hétérozygotes GMR-GAL4 exprimant
seulement GAL4 et chacune des trois lignées d'UAS-127Q sans GMR-GAL4 a eu une
morphologie et une distribution de colorant d'œil externe et interne normale.
Fig. 1. Suppression génétique de l’effet toxique de 127Q
dans l’œil de mouche. SEM, microscope à scanner à
électrons ; FITC, Sections gelées marquées avec un anticorps
de marquage HA sur le peptide 127Q (vert) ; FITC+DAPI,
double exposition DAPI pour les taches nucléaires (bleues).
(A) Contrôle, expression de GAL4 régulée par GMR,
l’enhancer/promoteur spécifique de l’œil, en absence de
127Q. La pigmentation rouge est due à l’expression du
marqueur de gène white+ sur l’élément P GMR. Aucun
agrégat n’a été observe avec FITC. DAPI montre un
arrangement normal des nuclei. (B) Les mouches qui
expriment le peptide 127Q conduit par GMR-GAL4. L’œil a grossièrement la taille normale,
mais est sévèrement mal formé. La lumière microscopique montre l’absence de pigments.
FITC montre de nombreux agrégats de polyglutamine fluorescents, la plupart localisés dans
les nuclei, comme vu par recoupement avec DAPI. (C) Insertion d’élément P suppresseur
EU3500 qui restore la structure externe et la pigmentation de l’œil. FITC et DAPI colorent les
structures internes rétiniennes améliorées, en dépit de la présence des agrégats de
polyglutamine. (D) Confirmation de la suppression dans les mouches transgéniques avec le
cDNA dhdJ1, correspondant au 3' du gène de l’insertion d’élément P EU3500. Une nouvelle
fois, la structure de l’œil est largement restaurée, en dépit du fait que les agrégats de
polyglutamine sont toujours présents. Comme indiqué par le recoupement des colorations au
DAPI et FITC, les inclusions nucléaires de polyglutamine sont présentes en périphérie de la
rétine, alors que dans la rétine proximale (interne), le marquage au FITC indique seulement
des inclusions cytoplasmiques. (E) Un second élément P suppresseur inséré, EU3220,
améliore aussi la structure externe et la pigmentation, bien que (albeit) moins effective que
EU3500. Les marquages au FITC et DAPI montrent une amélioration de la structure interne
de la rétine, avec des dégénérescences rétiniennes. (F) Confirmation de la suppression dans
les mouches transgéniques avec le cDNA dtrp2, correspondant au 3' du gène de l’élément P
EU3220 inséré. [View Larger Version of this Image (108K GIF file)]
Les mouches GMR-GAL4/UAS-127Q ont des anomalies extérieurement évidentes graves
d'œil (Fig. 1) et ont été employées pour observer des modificateurs dominants de la toxicité de
la répétition 127Q en examinant les gènes à proximité d'une série d'emplacements
chromosomiques d'insertion de l’élément P. Ceci a été fait en les croisant avec environ 7000
brins d’insertion autosomaux de nouveau générés de l’élément (13) et en évaluant la
progéniture F1 pour la suppression ou le perfectionnement du phénotype d'œil. On a établi
trente lignées qui ont supprimé la dégénérescence polyglutamine-dépendante de l’œil dans des
mouches hétérozygotes et 29 lignées ont été fabriquées, qui les perfectionnent (14). La
délivrance de plasmide des éléments P et le flanquement d’ADN génomique a été exécutée

(15), et le cDNA correspondant à l'emplacement d'insertion de l’élément P a été employé pour
examiner sa capacité à supprimer la toxicité de polyglutamine. Ici nous rapportons les
résultats pour les deux premières lignées pour lesquelles les effets de suppression ont été
directement confirmés.
Dans la première lignée, EU3500, la séquence génomique, commençant 98 paires de bases
(pb) en aval de l'élément P, a atteint un tag de séquence exprimée (EST) dans la base de
données du projet de génome de drosophile de Berkeley (BDGP) (15). Au moins trois clones
indépendants de cDNA dans la base de données ont eu des séquences semblables mais des
longueurs différentes de 3 ' UTR. Pour l'essai, GH26396 (16) a été choisi, qui est un cDNA de
1711 paires de bases qui code dHDJ1, une protéine prévue à 334 acides aminés et d’un poids
moléculaire de 37kD, qui a un domaine J NH2-terminal et homologue au HSP40/HDJ1
humain (identité de 54% et similitude de 72%) (Fig. 2) (17-19).
Fig. 2. Alignment of Drosophila (dHDJ1) and human
HSP40 (hHsp40/HDJ1). The amino acid sequences are 54%
identical and 72% similar (37). The J regions (23) are
underlined. These are 74% identical and 88% similar. Light
gray shading indicates similarity; dark gray shading indicates
identity. [View Larger Version of this Image (48K GIF file)]
Pour la deuxième lignée de suppresseur, EU3220, la séquence commençant 293 pb en aval
l'élément P a atteint un EST, et le clone cDNA correspondant GH09432 (16) a été séquencé.
L'insertion de l’élément P était 649 pb en 5 ' du cadre ouvert de lecture (ORF) d'un cDNA de
2239 pb, correspondant à une protéine prévue de 508 acides aminés et à un poids moléculaire
de 58 kD qui contient 7 répétitions de tetratricopeptide et un domaine J COOH-terminal. Une
recherche de base de données de protéine a indiqué l'homologie élevée (identité de 46% et
similarité de 67%) entre ceci et la protéine humaine répétée tetratricopeptidique 2 (TPR2) (20,
21) (Fig. 3). Nous l'avons donc appelée la protéine 2 (dTPR2) de répétition de
tetratricopeptide de Drosophila.
Fig. 3. Alignment of Drosophila (dTPR2) and the human
tetratricopeptide repeat protein 2 (hTPR2) (21). The amino
acid sequences are 46% identical and 67% similar (37). The
J regions (underlined) are 74% identical and 93% similar. In
addition, there are seven tetratricopeptide repeat motifs,
indicated by arrows. Shading is the same as in Fig. 2. [View
Larger Version of this Image (77K GIF file)]
Comme vu en microscopie électronique à balayage, les yeux anormaux des mouches GMR-
GAL4/UAS-127Q ont été spectaculairement améliorés en présence de l'insertion du
suppresseur de l’élément P dans le brin EU3500 (Fig. 1C). Avec cette insertion, l'œil préserve
sa structure globulaire, pigmentation, et un arrangement uniforme des poils. Bien que le

résultat soit plus faible que dans EU3500, l’élément P suppresseur dans le brin EU3220 a
également montré un effet spectaculaire (Fig. 1E).
La structure interne de l'œil a été examinée sur des coupes horizontales de tête réalisées au
cryostat. Dans les mouches non-délétées GMR-GAL4/UAS-127Q, la structure a été déformée
et l’immunomarquage des peptides Ha-tagged de polyglutamine a montré de nombreux
agrégats de l'isothiocyanate de fluorescéine (FITC) (Fig. 1B). En présence de l’insert du
suppresseur dans le brin EU3500, la structure rétinienne a été énormément améliorée (Fig.
1C) quoique le nombre d'agrégats ait demeuré semblable. En présence d'EU3220, l'effet était
similaire mais plus faible (Fig. 1E).
Pour examiner si le gène immédiatement 3 ' à l'insertion EU3500 était en effet responsable de
la suppression observée, le cDNA correspondant dans GH26396, qui contient les séquences
codantes pour dHDJ1, a été placé dans le vecteur transgénique (22) et micro-injecté dans des
embryons de mouche aux étapes précoces. Chacune des trois lignes transgéniques
indépendantes, chacune portant une insertion hétérozygote autosomale d'UAS-dhdJ1 en
présence de GMR-GAL4/UAS-127Q, a étroitement reproduit le phénotype de la ligne
EU3500 (Fig. 1D). Ceci a confirmé que la dégénérescence polyglutamine-dépendante de l’œil
par l’insertion de l’élément P et ses antagonistes transgéniques était en effet due à l’action de
dHDJ1. De façon similaire, le test transgénique, qui utilisait 3 lignées transgéniques
indépendantes portant une insertion UAS-dtpr2 hétérozygote avec GMR-GAL4/UAS-127Q, a
confirmé que la suppression par l’élément P EU3220 et ses antagonistes transgéniques est due
à l’action de dTPR2 (Fig. 1F).
Les Drosophila dHDJ1 et dTPR2 ont chacune un domaine J, une portion de près de 70 acides
amines trouvés dans les protéines J qui stimulent l’activité adénosine triphosphate de HSP70
(23), ce qui provoque la fermeture des sites de fixation de peptide, piégeant ainsi les substrats
de protéines (24). Les protéines J lient aussi indépendamment d’autres protéines pour former
des structures secondaires et tertiaires (25).
L’évidence directe pour le rôle des HSPs, particulièrement les protéines J, pour empêcher
l’agrégation des protéines a été apportée in vitro en montrant qu’un excès molaire de 5 plis de
l’ADNJ d’Escherichia coli a complètement supprimé l’agrégation d’une protéine substrat
(rhodanese mitochondriale bovine) (26). Les protéines J doivent aussi jouer un rôle dans la
voie de dégradation du protéasome parce qu’un grand antigène T (Tag) du domaine J du virus
simien 40 (SV40) fut requis pour la dégradation protéasome-dépendante de p130 (relatif à la
protéine suppresseur de tumeur du rétinoblastome, pRB) dans la lignée cellulaire
osteosarcome humaine U-2 OS (27). En effet, le domaine J de deux autres paralogues du
HSP40 humain, HDJ2 (aussi connu sous le nom de DNAJ2), ou HSJ1 peut substituer le
domaine J dans le Tag de SV40, et la substitution d’une glutamine pour une histidine
conservée dans le domaine J pourraient avoir aboli cet effet.
Le TPR2 de Drosophila peut aussi agir comme un suppresseur dans une autre voie. Les
domaines TPR sont constitutes de 3 à 16 répétitions dégénérées d’une portion de 34 acides
aminés, dont chacun formant une paire d’hélice α antiparallèles (28). Les unités TRP tandem
multiples assemblés dans une structure super-hélicoïdale droite qui se prêtent à des interfaces
protéine-protéine. Ils se trouvent dans des protéines impliquées dans des fonctions varies,
incluant l’import de protéines, la neurogenèse, la réponse au stress, et l’action chaperonne (21,
29). Le TPR2 humain a été isolé d’une bibliothèque de cDNA de cellule HeLa dans un
controle à double hybride, utilisant une “amorce” d’un fragment de 271 acides aminés d’un

domaine relié à une protéine activatrice de guanine triphosphate (GTPase) (GRD) de
neurofibromine, le produit du gène de la neurofibromatose de type 1 (NF1) (21). La
neurofibromine stimule l’activité GTPase de p21 Ras et le converti à partir de la forme active
(Ras-GTP) en sa forme inactive (Ras-GDP) (30). Il est concevable que la surexpression de
dTPR2 dans l’œil de drosophile inhibe l’homologue de neurofibromine de Drosophila (dNF1)
(31) en masquant son GRD. Ceci pourrait augmenter l’activité de Ras-GTP, qui est connu
pour inhiber la protéine déficiente de l’involution de la tête proapoptotique (HID) (32) et
d’augmenter la survie des cellules de l’œil.
Dans les transfections de cellules en culture avec une ataxine-1 entière ou le récepteur à
androgènes, chacun avec une polyglutamine étendue, co-exprimant HDJ2/HSDJ résulta en
une réduction de 40 à 50% du nombre de cellules contenant des agrégats (33, 34). De façon
similaire à l’effet de HSPA1L, l’EU3500 ou l’élément P EU3220 ou l’expression de leur
antagoniste transgénique inhibèrent la détérioration de la structure de l’œil, mais la formation
d’agrégats ne fut pas supprimée. Parce que le promoteur GMR agit précocement dans le
développement de l’œil, il est possible que dHDJ1 et dTPR2 agissent à ce stade précoce de
différenciation, en se liant au 127Q et en maintenant le milieu non-toxique, permettant ainsi
au développement de l’œil de ce faire plus normalement. Réciproquement, ces protéines
suppresseurs, plutôt que d’interagir directement avec le peptide 127Q, doivent réduire sa
toxicité par un effet en aval.
Les nombreux brins suppresseurs déjà en main doivent mener à la découverte d’autres gènes
concernant la pathogenèse de divers désordres de polyglutamine et leur traitement
prophylactique ou thérapeutique.
REFERENCES AND NOTES
1. T. W. Kim and R. E. Tanzi, Neuron 21, 657 (1998) [CrossRef] [ISI] [Medline] .
2. Y. Trottier, et al., Nature 378, 403 (1995) [CrossRef] [Medline] .
3. J. M. Warrick, et al., Cell 93, 939 (1998) [CrossRef] [ISI] [Medline] .
4. G. R. Jackson, et al., Neuron 21, 633 (1998) [CrossRef] [ISI] [Medline] ; J. L. Marsh,
et al., Hum. Mol. Genet. 9, 13 (2000) [Abstract/Free Full Text] .
5. J. M. Warrick, et al., Nature Genet. 23, 425 (1999) [CrossRef] [ISI] [Medline] .
6. Because it has one of the longest known CAG tracts in the fly (20 repeats), the
prospero gene in the p139cAC1 plasmid (35) was used as a template for PCR
synthesis of expanded polyCAG tracts. Primers used to amplify two fragments
containing polyCAG tracts were as follows: (i) ProsBamHI3229F (5'-ATG CGC GGA
TCC CAG CAG CTG GAG CAG AAC GAG GCC-3') with 5' phosphorylated-
ProsAflIIR (5'-ATT GCT GTT GCC GCC GTT CTT AAG CTG TTG TTG TTG
CTG TTG TTG-3') and (ii) ProsBstBIF (5'-ACC GGA GGC CCA CCG TCA TTC
GAA CAG CAG CAG CAA CAG-3') with Pros3650R (5'-GCT GCG TGC GGA
TTG AAG AAC GGC-3'). These fragments were digested with Bam HI (5' fragment)
or Bst XI (3' fragment) and ligated with T4 DNA ligase (Gibco/BRL) into the Bam
HI-Bst XI fragment of p139cAC1. After cloning and amplifying this construct in XL1
Blue strain of E. coli (Stratagene), the sequence between the two polyCAG tracts was
removed by digesting with Bst BI and Afl II (or Bfr I) and trimming the overhanging
ends with mung bean nuclease (New England Biolabs), followed by ligation and
transformation into XL1 Blue. To synthesize polyCAG of 127 repeats, this procedure
was repeated twice more. To produce UAS-20Q and UAS-127Q, polyCAG20 and
polyCAG127 and their flanking sequences were PCR-amplified by primers 5' Gln2F
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%