Utiliser l ` animation « spectres » pour visualiser le

A01P CH03P La lumière due à la quantification des niveaux d’énergie de l’atome
I) Spectres de raies d’émission ( émis par un gaz sous faible pression excité par un courant ) :
Une lampe à décharge est un tube de verre contenant un gaz sous faible pression. ( vapeurs de sodium, vapeurs de mercure, …).
Lorsque le gaz est traversé par une décharge électrique, il émet de la lumière dont le spectre est obtenu grâce au réseau.
Utiliser l ’ animation « spectres » pour visualiser le spectre d ’ émission de l’ a tome de sodium.
400n 800n
Spectre de raies d’émission de l’atome de sodium
II) Spectres de raies d’absorption:
La lumière blanche traverse un tube de verre contenant un gaz sous faible pression. ( vapeurs de sodium, vapeurs de mercure, …).
Le réseau permet d’obtenir le spectre de la lumière après traversée du gaz .
Utiliser l ’ animation « spectres » pour visualiser le spectre d ’ absorption de l ’ atome de sodium.
400n 800n
Spectre de raies d’absorption de l’atome de sodium
3) Conclusion: comparer les spectres d’absorption et d’émission du sodium
………………………………………………………………………………………………………………………………………………..
……………………………………………………………………………………………………………………………………………….
……………………………………………………………………………………………………………………………………………….
III) Quantification des niveaux d’énergie d’un atome Faire l’activité 3 p 48 puis compléter le1)
1) Les différents niveaux d’énergie d’un atome
Postulat: L’……………….d’un atome ne peut prendre que des valeurs bien définies appelées niveaux d’énergie: elle est quantifiée.
Définition: Le niveau d’énergie le plus faible d’un atome correspond à son état stable. Il est appelé ……………………………..
Les niveaux d’énergie plus élevés que l’état fondamental correspondent à des ……………………………………..
Rq: Les valeurs des énergies des atomes étant extrêmement faibles lorsqu’elles sont exprimées en joules (J), on utilisera souvent l’élec-
tron-volt ( eV).
1eV = …………………………. J

3) Le photon.
Les ondes électromagnétiques se déplacent à la vitesse de la lumière dans le vide ou dans l’air ( c = 3,0.108 m.s-1) et sont ca-
ractérisées par 2 grandeurs :La longueur d’onde (m) dans le vide ou dans l’air et (ou) la fréquence (Hz) avec
...
L’énergie de la lumière et des ondes électromagnétiques en général est transportée par des corpuscules appelés photons.
L’énergie transportée par un photon s’exprime en fonction de la fréquence (Hz) de la radiation correspondante et de la cons-
tante de Planck (h = 6,63.10-34 J.s) selon
...
L’énergie transportée par un photon s’exprime en fonction de la longueur d’onde (m) de la radiation correspondante et de la
constante de Planck (h = 6,63.10-34 J.s) selon
est
...
Les photons peuvent être émis lors de la désexcitation d’un atome. Ce processus est à l’origine du spectre d’émission d’un ato-
me.(§IV)
Les photons peuvent être absorbés par un atome et provoquer son excitation. Ce processus est à l’origine du spectre d’absorp-
tion d’un atome.(§V)
Ex:
1) Trouver les fréquences limites des radiations du domaine visible.
2)Trouver l’énergie transporté par ces radiations en utilisant la formule liant E et puis en utilisant la formule liant E ,c et
2) Transitions atomiques:
Définition: Le passage d’un niveau d’énergie Ei à un autre Ef est appelé transition.
Si Ei < Ef, l’atome reçoit de l’énergie du milieu extérieur (il subit une excitation).
Si Ei > Ef, l’atome fournit de l’énergie au milieu extérieur (il subit une désexcitation).

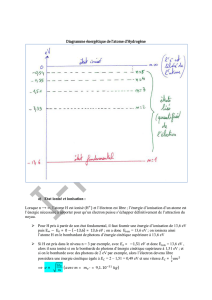
IV) Comprendre le spectre d’émission :
Schématiser le diagramme énergétique d’un atome en symbolisant la transition énergétique qui conduit à l’émission d’une raie .
V) Comprendre le spectre d’absorption :
Schématiser le diagramme énergétique d’un atome en symbolisant la transition énergétique qui conduit à l’absorption d’une raie .
Ex: Schématiser la transition qui correspond à la raie noire de 487nm.
Exemple: Quelle raie colorée du spectre correspond à cette transition?

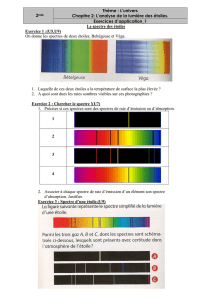
V) Application de l’étude des spectres aux caractéristiques d’une étoile
1) Spectre continu et température de l’étoile:
Retrouver quel spectre correspond à chacune des étoiles suivantes:
2) Spectre de raies et composition de la chromosphère d’une étoile:
Utiliser l’animation «analyse spectrale » pour déterminer la composition de la chromosphère de Véga .
1) Quelle est l ’ origine des raies noires observées dans le spectre?
2) Schématiser qualitativement la formation d ’ une de ces raies par un diagramme énergétique.
...
...
...
Visionner l’animation « spectre et composition chimique du Soleil » du CEA
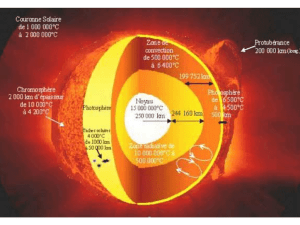
Une étoile est une énorme boule de gaz très chaud et très condensé.
La lumière qui nous parvient est issue de la surface de l’étoile appelée photosphère.
La lumière issue de la photosphère traverse la chromosphère .
Les astronomes observe le spectre de l’étoile pour en déterminer sa température et la composition
de son atmosphère.
Le spectre continu issu de la photosphère nous renseigne sur la température de surface de l’étoile.
Les raies sombres observées sur le spectre nous renseigne sur la composition de la chromosphère.
Nom Couleur max du profil spectral T°
Domaine spectral de max
Naine rouge 3500 K
Delta Orionis 83 nm
Soleil 6000 K
1
/
4
100%