I. La réfraction (7 points)

18/04/2017 840911358 1/4
NOM : ................................................
Prénom : ................................................
Classe : 2nde 2
Le 14/11/2013
Devoir n°2 (1h30min) - Calculatrice autorisée
Page : 1/4
I. La réfraction (7 points)
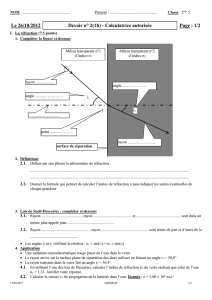
Un rayon de lumière rouge (en noir sur le schéma) issu d’une source laser et se propageant dans l’air, arrive sur la
face plane d’un demi-cylindre de plexiglas.
1. Répondre à l’aide du schéma ci-dessous
1.1. Comment se nomme le rayon noté 1 ? ................................................ ................................................
1.2. Comment se nomme le rayon noté 2 ? ................................................ ................................................
1.3. Comment se nomme le rayon noté 3 ? ................................................ ................................................
1.4. Quel est le rayon caractéristique de la réfraction ? ................................................
1.5. Quel est le rayon caractéristique de la réflexion ? ................................................
1.6. Indiquer sur le schéma, par un trait vert, la ligne (ou surface) de séparation entre l’air et le plexiglas.
1.7. Indiquer, par un trait bleu, sur le schéma la normale à la ligne (ou surface) de séparation
1.8. Repérer sur le schéma l’angle d’incidence noté i1. Donner sa valeur i1 au degré près : i1 = ............
1.9. Repérer sur le schéma l’angle de réfraction noté i2. Donner sa valeur i2 au degré près : i2 = ............
2. Indice de réfraction
L’indice de réfraction d’un milieu transparent dépend de la vitesse dans le milieu selon la relation : nmilieu =
Error!
avec v vitesse de la lumière dans le milieu et c vitesse de la lumière dans le vide.
Données : vitesse de la lumière dans le vide ou dans l’air : c = 3,00 108 m.s-1
2.1. Calculer la valeur de l’indice de l’air nair. Justifier votre réponse.
2.2. Si l’indice du milieu est nmilieu =1,33, quelle est la vitesse v de la lumière dans ce milieu ?
1
2
3
plexiglas
air

18/04/2017 840911358 2/4
3. 3ème loi de Snell-Descartes
3.1. Cocher la relation mathématique correspondant à l’expression de la 3ème loi de Descartes dans ce cas de
figure.
nair sin(54°) = nplexi sin(67°)
nair sin(36°) = nplexi sin(23°)
nair sin(23°) = nplexi sin(36°)
nair sin(67°) = nplexi sin(54°)
3.2. Déterminer l’indice de réfraction nplexi du plexiglas. Détailler votre calcul.
On fait maintenant tourner le disque gradué de façon à ce que le rayon arrive sur la face plane du demi-cylindre
avec un angle d’incidence de 54°.
3.3. Utiliser la 3ème loi de Descartes pour calculer l’angle de réfraction (à 1° près). Détailler votre raisonnement et
vos calculs. (Si vous n’avez pas la valeur de l’indice de réfraction nplexi du plexiglas, prendre nplexi = 1,33).
II. Les longueurs et leur écriture (3 points)
1. Indiquer la (ou les) bonne(s) réponse(s) en cochant la case correspondante
1.1. Un atome a pour diamètre moyen 0,000 000 000 1 m soit :
10-9 m
10-11 m
10-10 m
10-14 m
1011 m
1010 m
1.2. Notre galaxie fait 946 000 000 000 000 000 km de long ce qui représente :
9,461015 km
9,461014 m
9,461017 km
9,4610-14 km
9,461017 m
9,461020 m
1.3. Le rayon de la Terre fait 6 400 000 m soit :
6,4 102 m
6,4 102 km
6,4 103 m
6,4 103 km
6,4 106 km
6,4 106 m
2. Compléter le tableau suivant :
Longueurs L
12µm
15,5 km
0,56 cm
0,75 mm
longueur L
convertie en m
Notation scientifique
de L en m

18/04/2017 840911358 3/4
III. Atome et structure électronique (3 points)
On donne le numéro atomique des atomes suivants : aluminium, Al (Z = 13) ; Néon, Ne (Z = 10)
1) Que représente la lettre Z pour le noyau de l’atome ?
...............................................................................................................................................................
2) Combien d'électrons possède chaque atome ? Justifier.
...............................................................................................................................................................
...............................................................................................................................................................
3) Etablir la structure électronique de chaque atome dans son état fondamental. Justifier votre réponse.
...............................................................................................................................................................
...............................................................................................................................................................
4) Déterminer le nombre d'électrons sur la couche externe pour chaque atome.
...............................................................................................................................................................
...............................................................................................................................................................
5) L’un des atomes est susceptible de former un ion. Lequel ? Quel est alors cet ion ? Justifier votre réponse.
...............................................................................................................................................................
...............................................................................................................................................................
...............................................................................................................................................................
IV. Qu’est-ce qu’un ion ? (5 points)
C’est le chimiste suédois Svante August Arrhenius qui fut le premier, vers 1880, à découvrir que certaines
substances en solution se trouvent sous la forme d’ions et non de molécules.
1) Compléter : Un ion est un atome qui a ...................... ou .................... un (ou plusieurs) électron(s).
On extrait le sel de cuisine dans les marais salants et les mines de sel. On peut le fabriquer artificiellement au
laboratoire : on fait réagir le métal sodium Na avec le gaz dichlore Cl2 (la réaction est violente !). Il se forme à la
fin de la transformation du chlorure de sodium : c’est un solide constitué d’ions sodium Na+ et d’ions chlorure Cl-.
2) Compléter le tableau suivant et les questions 3) et 4) avec les mots qui conviennent parmi cette liste :
négatifs ; chlorure ; perdu ; sodium ; gagné ; chlore ; Na+ ; Cl - ; positifs ; e- (certains mots peuvent être utilisés
plusieurs fois)
Formation des ions ..........................
Formation des ions .............................
Les atomes Na se transforment en ions ............
Les ions ............ sont des atomes de ........................
qui ont ............ un électron
Ce qui s’écrit : Na ............ + ............
Les atomes Cl se transforment en ions ............
Les ions ............ sont des atomes de ......................
qui ont ............ un électron
Ce qui s’écrit : Cl + ............ ............
3) Compléter : L’électron gagné par l’atome de ..................................... a été donné par l’atome de
........................................
4) Compléter : Pour que la matière reste électriquement neutre, des ions .......................................... sont toujours
associés à des ions ..........................................

18/04/2017 840911358 4/4
5) Comment mémoriser de façon simple cation et anion ? Définir alors un cation.
6) Compléter le tableau suivant :
Atome
structure électronique
de l’atome
structure électronique
de l’ion
même structure
électronique que
Symbole
de l’ion
Ex : Li
K(2)L(1)
perd un e–
K(2)
He
Li+
F
K(2)L(7)
............
............
Ne
............
Mg
K(2)L(8)M(2)
............
............
Ne
............
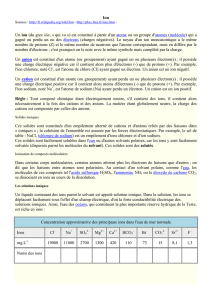
V. Identifications des ions (2 points)
Indications : Identification des ions en solution :
Ion
ion chlorure Cl-
ion sulfate SO42-
ion cuivre II Cu2+
ion fer II Fe2+
ion fer III Fe3+
Réactif
solution de
nitrate d’argent
solution de chlorure
de baryum
solution de soude ou solution d’hydroxyde de sodium
Couleur
du précipité
blanc (qui noircit à
la lumière du soleil)
blanc
bleu
vert
rouille
Rédiger soigneusement un protocole permettant de mettre en évidence les ions contenus dans une solution de
chlorure de fer III. Faire des schémas légendés.
1
/
4
100%