pile_conversion_d_energie

Groupe recherche formation-Strasbourg
Fiche professeur
Thème du programme : Agir. Défi du XXIème
siècle.
Sous thème : Convertir l’énergie et
économiser les ressources
C o n v e r t i r l ’ é n e r g i e e t é c o n o m i s e r l e s r e s s o u r c e s
Type d’activité : Activité documentaire vidéo
Conditions de mise en oeuvre : Etude de documents (papiers ou sur sites Internet) présentant
les piles et les accumulateurs.
Démarche expérimentale pour réaliser une pile et modéliser son fonctionnement.
Pré- requis :
Générateur.
Nature du courant électrique.
Unités de tension électrique et d’intensité de courant électrique.
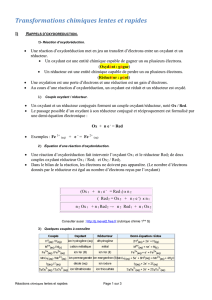
NOTIONS ET CONTENUS
COMPETENCES ATTENDUES
Oxydant, réducteur, couple
oxydant/réducteur, réaction
d’oxydoréduction.
Modèle par transfert d’électrons.
Reconnaître l’oxydant et le réducteur dans un couple.
Écrire l’équation d’une réaction d’oxydoréduction en
utilisant les demi- équations redox.
Compétences transversales : (préambule du programme et socle commun)
- Rechercher, extraire, organiser des informations utiles.
- Raisonner, argumenter, démontrer.
- Présenter la démarche suivie, les résultats obtenus, communiquer à l’aide
d’un langage adapté.
- Faire une communication orale.
Mots clés de recherche : oxydant ; réducteur ; transfert d’électrons ; oxydoréduction.
Adresses sites intéressants :
http://lchamp.com/SPCTerm/chimie/etude_piles/cours.html

Groupe recherche formation-Strasbourg
I] A la découverte des couples oxydant/réducteur
1. retour à la pile Volta
a) Rappelez la borne négative :
b) Quels porteurs de charges produit-elle ?
c) Simultanément que se passe-t-il pour le
conducteur matérialisant la borne négative ?
d) Quel conducteur capte les porteurs de
charges produits par la borne négative ?
e) Où se fixent-ils si l’électrolyte est l’acide
sulfurique ?
f) quel est le rôle de l’électrolyte ?
2) Conducteur d’électrons
a) A partir de la mesure de la tension électrique, quelle conducteur matérialise la borne négative ?
b) Quelle particule chargée est fournie par ce conducteur, où circule-t-elle ?
c) Quel conducteur accepte ces particules chargées ?
3) A la découverte des couples
a) Si le conducteur fournit ou libère des charges électriques : électrons, il se nomme réducteur,
identifiez le et symbolisez cette action par une équation qu’il faudra équilibrer.
b) Si le conducteur accepte ou capte des charges électriques : électrons, il se nomme oxydant,
identifiez le et symbolisez cette action par une équation qu’il faudra équilibrer.
c) Ecrire le couple oxydant/réducteur dans chaque cas.
d) Quelle entité est échangée entre les deux couples ?
e) Compte tenu de cet échange écrire l’équation bilan.
f) Pourquoi la nomme-t-on l’équation équation d’oxydoréduction ?
4) Rôle de la solution aqueuse
a) Les électrons ont-ils la possibilité de circuler dans les solutions aqueuses ?
b) Comment peuvent-ils tout de même circuler dans les conducteurs solides ?
c) La solution aqueuse se nomme électrolyte, argumentez.
II] Des couples oxydant/réducteur vers la réaction d’oxydoréduction
1. Symbole d’une pile
La pile,de type Volta, est symbolisé
par: Zn(s) /H2SO4(aq)/ Cu,
conducteur solide / électrolyte / conducteur solide
borne négative borne positive

Groupe recherche formation-Strasbourg
2. couple oxydant/réducteur
Sur le Zinc :
Zn(s) → Zn(aq)++ + 2 e- (1) couple (Zn++ / Zn)
Le métal où les atomes Zn deviennent des ions
Zn(aq)++ en laissent des électrons libres dans le
métal de l'électrode.
Les ions Zn(aq)++ passent en solution.
Les électrons libérés se déplacent vers l'autre
électrode, par un autre chemin : par les
conducteurs du "circuit extérieur".
En effet, les électrons ne peuvent se déplacer que
dans des conducteurs, tandis que les ions ne
peuvent se déplacer que dans des conducteurs
ioniques.
Sur le cuivre :
2H(aq)+ + 2 e- → H2(g) ↑ (2) couple (H+ / H2 )
Les ions H(aq)+, venus de la solution électrolyte
acide, rencontrent les électrons, venus de l'autre
électrode par le circuit extérieur.
Ces deux particules se combinent en atomes H
qui se combinent à leur tour en molécules H2
formant des bulles gazeuses d'hydrogène qui se
dégagent
Zn subit une oxydation en cédant des électrons
tandis que les ions H+ subissent une réduction en prenant des électrons.
3. réaction d’oxydoréduction
L'addition des deux demi -réactions (1) et (2)ou encore des deux demi -équations redox, nous conduit
à la réaction chimique globale d'oxydo-réduction (3) qui traduit le transfert d’électrons d’un couple à
un autre:
Borne + : (2H+ / H2) (Cu) : 2H+ (aq)+ 2 e- → H2 ↑(g) (2) : Réduction cathodique
Borne - : (Zn++ / Zn) (Zn): Zn (s)→ Zn + + (aq)+ 2 e- (1) : Oxydation anodique
__________________________
Réaction globale: Zn (s)+ 2H+ (aq)→ Zn + + (aq)+ H2 ↑ (g) et énergie électrique (3)
Des réactions chimiques d'oxydoréduction : réactions électrochimiques où s'opère le transfert d'un
type de porteurs de charges (les électrons) à un autre type de porteurs de charges électriques (les
ions).
4. conversion d’énergie
a) Une pile produit de l'énergie électrique si les deux systèmes « oxydo-réducteurs » (aux deux
électrodes) fonctionnent spontanément à des potentiels différents.
b) Ces potentiels différents se caractérisent par une tension électrique U(PN) aux bornes de la pile
ainsi constituée.
c) La transformation chimique se caractérise par une énergie chimique qui se convertira en énergie
électrique par la production de porteurs de charge électrons, ces derniers permettent l’existence de
courant électrique d’intensité I.

Groupe recherche formation-Strasbourg
III] Applications.
1. pile scolaire
Réaction d'oxydation Réaction de
À la borne : Mg → + 2 e- À la borne positive : 2H2O + 2 e- → H2 +
Précisez l’oxydant et le réducteur ainsi que le couple correspondant à chaque demi -équation redox
Ecrire l’équation d’oxydoréduction.
2. La pile Daniell
a) date de la découverte
b) Précisez l’oxydant et le réducteur ainsi que le
couple correspondant à chaque demi -équation
redox ?
c) Ecrire l’équation d’oxydoréduction.
d) Quel est le rôle du vase poreux ?
e) Expliquez le choix de l’électrolyte ?
f) Nommez l’appareil électrique, que
mesure-t-il ?
http://www.ostralo.net/3_animations/swf/pile.swf
3. La pile Leclanché
a) Date de la découverte ?
b) Précisez l’oxydant et le réducteur ainsi que le
couple correspondant à chaque demi -équation
redox ?
c) Ecrire l’équation d’oxydoréduction.
d) Expliquez le choix de l’électrolyte ?
e) Que représente la f.e.m. ?

Groupe recherche formation-Strasbourg
4. La pile au lithium
a) Date de la découverte ?
b) Précisez l’oxydant et le réducteur.
ainsi que le couple correspondant.
à chaque demi -équation redox
c) Ecrire l’équation d’oxydoréduction.
d) Expliquez le choix de l’électrolyte ?
e) Que représente la f.e.m. ?
f) Que dire de sa valeur par rapport à la pile Leclanché ?
5. La pile bouton
a) Date de la découverte ?
b) Précisez l’oxydant et le réducteur.
ainsi que le couple correspondant à chaque
demi -équation redox
c) Expliquez le choix de l’électrolyte ?
d) Que pensez vous de l’évolution des
dimensions de cette pile ?
e) Que dire de ses dangers après utilisation ?
f) Quelles utilisations en fait-on ?
1
/
5
100%