chapitre 5 : la classification periodique des elements

Page 1 sur 3
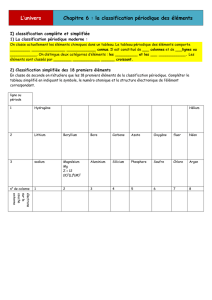
CHAPITRE 5 : LA CLASSIFICATION PERIODIQUE DES ELEMENTS
I) LES REGLES DU DUET ET DE L’OCTET
Voir activité : Les gaz nobles-règle du duet et de l’octet-formation des ions
I-1) Les gaz nobles
Structure électronique des gaz nobles
Atome de gaz noble
Z
Formule électronique
Hélium (He)
2
Néon (Ne)
10
Argon (Ar)
18
Krypton (Kr)
36
Xénon (Xe)
54
K2L8M18N18O8
Les atomes d’hélium (He), de néon (Ne), d’argon (Ar), de krypton (Kr) et de Xénon (Xe) sont extrêmement
stables, ils ne réagissent quasiment pas avec les autres atomes : ils sont chimiquement ………………………….
L’inertie chimique, la grande stabilité des gaz rares est due à la configuration de leur couche électronique
externe :
- ……………………………………………………………………………………………………….. sur la couche externe K ;
- ……………………………………………………………………………………………………….. sur la couche électronique externe
pour les autres atomes de gaz nobles.
I-2) Règle du duet et de l’octet
Au cours des réactions chimiques, la couche externe des atomes a tendance à évoluer afin d’acquérir :
- une couche électronique externe en K2 ou duet d’électrons pour les atomes (Li, Be) dont le numéro
atomique est proche de celui de l’hélium (Z=2) ;
- une couche électronique externe en octet (8 électrons) pour les autres atomes.
N.B. Cette règle admet de nombreuses exceptions qui ne seront pas abordées dans le cours de seconde.
.
I-3) Formation des ions
L’évolution en duet ou en octet d’un atome peut se faire, entre autre, par gain ou pertes d’électrons pour
former des ions.
Voir activité
Exemples :

Page 2 sur 3
II) DESCRIPTION ET CONSTRUCTION DE LA CLASSIFICATION PERIODIQUE
(voir activité classification)
II-1) Description
Les éléments représentés par leurs ……………………………………….. sont disposés par ordre de numéro atomique Z
………………………………………...
La classification actuelle comporte ……….. lignes ou périodes et ………..colonnes.
II-2) Principe de construction
Voir annexe
La première période (ligne) correspond au remplissage de la …………………………………………………….
La deuxième période (ligne) correspond au remplissage de la …………………………………………………….
La troisième période (ligne) correspond au remplissage partiel de la …………………………………………………….
Les atomes d’une même colonne ont la même ………………………………………………………………………………………………
Exemples
Colonne de la classification
Nombre d’électrons externes
1ère colonne
2ème colonne
13ème colonne
16ème colonne
III) FAMILLES D’ELEMENTS
Les propriétés d’un élément sont essentiellement déterminées par sa structure électronique externe.
Les atomes des éléments d’une même colonne de la classification périodique ont donc des propriétés
chimiques ………………………………………….. (même nombre d’électrons sur la couche externe)
On dit alors que :
Les éléments d’une même colonne constituent une famille.
III-1) Famille des alcalins
La famille des alcalins est constituée des éléments de la première colonne de la classification (a l’exception de
l’hydrogène) : lithium (Li), sodium (Na), potassium (K), …
Tous les atomes M de cette famille possèdent ………… seul électron externe. Les alcalins sont souvent présents
dans la nature à l’état de cations ………… . Les corps simples correspondant sont des métaux.

Page 3 sur 3
III-2) Famille des halogènes
La famille des halogènes est constituée par les éléments de la dix-septième colonne de la classification : fluor
(F), chlore (Cl), brome (Br), iode (I),…
Tous les atomes X de cette famille possèdent ………. électrons externes. Les halogènes se rencontrent
fréquemment dans la nature à l’état d’anions halogénures ……… .
Les corps simples correspondant ont pour formule F2, Cl2, Br2, I2, …..
III-3) Famille des gaz nobles
La famille des gaz nobles est constituée par les éléments de la dernière colonne, la dix-huitième de la
classification : hélium (He), Néon (Ne), Argon (Ar), …
Les gaz nobles ont une grande inertie chimique et sont très stables. On les trouve en faible quantité dans
l’atmosphère sous forme de gaz monoatomiques.
IV) UTILISATION DE LA CLASSIFICATION PERIODIQUE
La place d’un élément dans la classification périodique donne le nombre d’électrons sur la couche externe de
l’atome (voir § II-2).
L’application de la règle du duet ou de l’octet permet de déterminer la charge électrique de l’ion
correspondant.
Exercice 1
Déterminer la charge de l’ion Sélénure
L’élément sélénium (S)e appartient à la 16ème colonne de la classification. A très faible dose, il joue un rôle
bénéfique dans le fonctionnement du système immunitaire humain, mais il devient très rapidement toxique à
des doses plus importantes. L’apport naturel en Sélénium dépend de sa teneur dans les sols et varie selon les
zones géographiques.
1. Déterminer le nombre d’électrons externes d’un atome de sélénium.
2. Donner, en justifiant, la formule de l’ion monoatomique stable qu’il peut former.
Exercice 2
Déterminer la charge de l’ion baryum
1. Quel est le nombre d’électrons externes
d’un atome de baryum Ba que l’on peut
trouver dans un cristal de withérite,
sachant qu’il appartient à la 2ème colonne.
2. Quel ion monoatomique stable peut-il
former ? Donner sa formule
1
/
3
100%