0809-1S-12fev

NOM : 12 fev 2009
COMPOSITION N° 2
PREMIERE S4
Durée : 3h00 Calculatrice autorisée
CHIMIE (20 points)
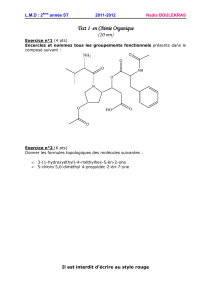
Exercice 1 (8 points)
L’étiquette d’un produit de jardinage indique qu’il renferme 25% en masse de cuivre. On
se propose de vérifier cette indication.
Protocole expérimental :
Etape 1 : On dissout 2,00 g du produit dans une fiole jaugée de volume V0 = 50,0 mL.
On obtient la solution S0.
Etape 2 : On prélève un volume V = 10,0 mL de solution S0 que l’on place dans un
erlenmeyer. On y ajoute un volume V’ = 25,0 mL d’une solution aqueuse d’iodure de
potassium (K+(aq) + I-(aq)) de concentration c’ = 1,00.10-1 mol.L-1 en soluté apporté.
On observe alors la formation d’un précipité blanc d’iodure de cuivre qui se forme lors de
la transformation suivante :
2 Cu2+(aq) + 4 I-(aq) 2 CuI (s) + I2 (aq)
Le précipité blanc d’iodure de cuivre, mélangé au diiode (marron) donne au mélange
présent dans l’erlenmeyer une couleur « café au lait ».
Remarque importante : on suppose que les ions iodure sont introduits en excès.
Etape 3 : On place l’erlenmeyer sous une burette graduée contenant une solution de
thiosulfate de potassium (2 K+(aq) + S2O32-(aq)) de concentration c = 1,00.10-1 mol.L-1.
On titre alors le diiode présent dans l’erlenmeyer. A l’équivalence, un volume de solution
titrante VE = 16,4 mL a été versé.
1 . Sachant qu’à part CuI (s) et I2 (aq), toutes les espèces chimiques concernées sont
incolores, indiquer comment l’équivalence a été repérée. (1 pt)
2 . Ecrire l’équation de la réaction de titrage. (2 pts)
3 . Calculer la quantité de matière de diiode qui a été formée lors de la première
transformation (2ème étape). (2 pts)
4 . En déduire la quantité de matière d’ions Cu2+ qui a été consommée lors de cette 2ème
étape. (1 pt)
5 . Calculer la concentration molaire en ion cuivre II de la solution obtenue par
dissolution du produit commercial dans la fiole jaugée de 50,0 mL. (1 pt)
6 . En déduire le pourcentage massique de cuivre dans le produit de jardinage. (1 pt)
Donnée : Couples ox / red : I2(aq) / I-(aq) S4O62-(aq) / S2O32-(aq)
M(Cu) = 63,5 g.mol-1
Exercice 2 (12 points)
La dureté d’une eau, est définie par la somme des concentrations en ions calcium et
magnésium, C = Ca2+ + Mg2+, présents dans l’eau.
En France, la dureté d’une eau s’exprime en degré hydrotimétrique français, noté D et
exprimé en °TH.
Par définition : D = 10.C si C est exprimé en mmol.L-1.

Une méthode pour déterminer la dureté d’une eau consiste à réaliser un titrage
complexométrique, qui fait intervenir des espèces chimiques appelées complexes.
Un complexe est un édifice chimique constitué d’un atome ou d’un cation central auquel
sont liés des molécules ou des ions appelés ligands.
_____________
La méthode proposée utilise l’ion éthylène diamine tétra acétate (nommé plus
simplement EDTA) qui est un ligand incolore et qui sera noté Y4-(aq) par la suite.
Les ions calcium et magnésium forment tous les deux un complexe incolore avec l’EDTA,
selon les équations chimiques suivantes :
Ca2+(aq) + Y4-(aq) CaY2-(aq)
Mg2+(aq) + Y4-(aq) MgY2-(aq)
Les complexes CaY2-et MgY2- étant incolores, il est nécessaire d’utiliser un indicateur
de fin de réaction. On choisit le noir ériochrome T (nommé plus simplement NET), qui
sera noté Ind (aq) par la suite. Dans une solution dont le pH est voisin de 9, le NET est
de couleur bleu. Avec les ions calcium ou magnésium, le NET forme un complexe de
couleur rose violacé selon les équation de réaction suivantes :
Ind (aq) + Ca2+(aq) Ca(Ind)2+(aq)
Ind (aq) + Mg2+(aq) Mg(Ind)2+(aq)
Principe du titrage :
Etape 1 : On introduit une prise d’essai de volume connu d’eau minérale à titrer dans
une solution dont le pH est voisin de 9. On ajoute alors très peu de NET dans la prise
d’essai. Le mélange prend une teinte rose violacé en raison de la formation des
complexes Ca(Ind)2+et Mg(Ind)2+.
Etape 2 : On ajoute ensuite progressivement la solution titrante d’EDTA au mélange, à
l’aide d’une burette graduée. Il y a formation des complexes incolores CaY2- et MgY2-.
Etape 3 : A l’équivalence, lorsque tous les ions calcium et magnésium ont été
consommés, l’EDTA réagit avec les complexes Ca(Ind)2+et Mg(Ind)2+selon les
réactions d’équation :
Ca(Ind)2+(aq) + Y4-(aq) CaY2-(aq) + Ind (aq)
Mg(Ind)2+(aq) + Y4-(aq) MgY2-(aq) + Ind (aq)
Le titrage est réalisé avec V = 10,0 mL d’eau minérale.
La solution d’EDTA utilisée a une concentration c’ = 2,5.10-3 mol.L-1.
Le volume de solution titrante versé à l’équivalence est : VE = 11,2 mL.
1 . Compléter le document de l’annexe en faisant la liste des espèces présentes dans la
prise d’essai au cours du titrage. Préciser la couleur du mélange avant et après
l’équivalence. (5 pts)
2 . Quelle(s) est(sont) l’(les) équation(s) de titrage utilisée(s) ? (2 pts)
3 . A l’équivalence, quelle relation peut on écrire qui relie la quantité d’EDTA versée ainsi
que les quantités d’ions Ca2+ et Mg2+ présents dans la prise d’essai avant que débute le
titrage ? (2 pts)
4 . Calculer C = Ca2+ + Mg2+ pour l’eau analysée. En déduire son degré
hydrotimétrique français D. (2 pts)
5 . L’étiquette sur la bouteille d’eau minérale analysée indique les concentrations
massiques en ions calcium et magnésium. On lit :
Calcium
106 mg.L-1

Magnésium
3,8 mg.L-1
Les résultats obtenus par titrage sont-ils conformes à ces indications ? (1 pt)
Données : M(Ca) = 40,1 g.mol-1 M(Mg) = 24,3 g.mol-1
PHYSIQUE (30 points)
Exercice 1 (14 points)
Un skieur nautique de masse m = 70 kg partant sans vitesse initiale du point A est tracté
par un canot par l’intermédiaire d’un câble tendu, parallèle au plan d’eau. Après un
parcours rectiligne de longueur L = 200 m, le skieur atteint la vitesse de 72 km.h-1 au
point B. (voir schéma n°1 en annexe)
1 . Représenter, sans souci d’échelle, sur le schéma n°2 en annexe, les forces qui
agissent sur le système entre A et B. (2 pts)
Quel est le travail de la résultante S des forces qui s’exercent sur le système skieur sur
le parcours AB ? (2 pts)
2 . Les forces extérieures qui agissent sur le système skieur sont supposées
constantes. En déduire la valeur de la résultante. (1,5 pts)
3 . On suppose que l’ensemble des forces de frottement (frottements de l’eau et de l’air)
est équivalent à une force unique de valeur f = 100 N. Calculer la valeur de la force de
traction exercée par le câble sur le skieur. (1,5 pts)
4 . Le skieur lâche le câble et aborde le tremplin de longueur BC = 10 m. L’angle que fait
le plan incliné avec l’horizontale vaut = 30°.
Les frottements moyens le long du tremplin sont équivalents à une force constante f’ =
500 N. Représenter sur le schéma n°3 en annexe les forces qui agissent sur le système
entre B et C. (1,5 pts)
Calculer la vitesse du skieur lorsqu’il passe en C, au sommet du tremplin. (2 pts)
5 . Le skieur quitte le tremplin en C. Il effectue le saut. On néglige les frottements de
l’air. La vitesse au sommet D de la trajectoire du skieur est vD = 9 m.s-1. Calculer la
hauteur du point D, en prenant comme origine des altitudes celle du plan d’eau. (2 pts)
6 . Avec quelle valeur de la vitesse le skieur retombe-t-il sur le plan d’eau ? (1,5 pts)
Donnée : g = 10 N.kg-1
Exercice 2 (9 points)
On considère une petite génératrice, c’est à dire un dispositif capable de convertir de
l’énergie mécanique en énergie électrique (il s’agit donc d’un générateur). La résistance
interne de cette génératrice est mesurée avec un ohmmètre : on mesure r = 0,800 .
G
+
-
poulie
fil
masse
R
R
R
v
P
N
A
B
I
I1I2

L’axe horizontal de la génératrice est relié à une poulie. Une masse m = 300 g est
suspendue à un fil enroulé dans la gorge de la poulie. Les bornes de la génératrice sont
connectées au circuit schématisé ci-dessus (R = 10 ).
La masse m est lâchée sans vitesse. Rapidement, elle prend une vitesse constante v =
18,0 cm.s-1. L’étude des variations et transferts d’énergie sera effectuée pour une durée
de chute t = 10,0 s, au cours de laquelle la masse m descend d’une hauteur h, à la
vitesse constante v.
1 . Calculer la résistance équivalente Req du circuit alimenté par la génératrice. (1 pt)
2 . Exprimer et calculer l’énergie Wg reçue par la génératrice lors de la chute de la
masse. (2 pts)
3 . En utilisant le principe de conservation de l’énergie, montrer que :
(Req + r).I2.t = m.g.h (2 pts)
4 . Calculer I ainsi que la f.e.m E de la génératrice. (1,5 pts)
5 . En déduire les valeurs de I1 et I2 . (2 pts)
6 . Calculer la tension UPN aux bornes de la génératrice. (0,5 pt)
Donnée : g = 10 N.kg-1
Exercice 3 (7 points)
On considère une cuve parallélépipédique dont les dimensions sont les suivantes :
Largeur : l = 20 cm hauteur : h = 2,0 cm longueur : L = 20 m
Ses parois sont isolées thermiquement sauf la paroi supérieure de dimensions 20 cm 20
m. Cette paroi est exposée au soleil et revêtue d’un plastique noir. Cela lui permet
d’absorber au mieux le rayonnement solaire (on limite ainsi au maximum la réflexion),
dont la puissance par unité de surface de la paroi est de 700 W.m-2.
La cuve est remplie d’eau, dont la température initiale est de 20 °C. On suppose que
toute l’énergie du rayonnement solaire est transmise à l’eau.
1 . Calculer la puissance du rayonnement solaire absorbé par la paroi. (1,5 pts)
2 . On souhaite augmenter la température de l’eau présente dans la cuve de 12 °C.
Quelle énergie doit-on fournir à cette quantité d’eau pour y parvenir ? (1,5 pts)
3 . En déduire la durée d’exposition au Soleil nécessaire pour effectuer ce réchauffement.
(1,5 pts)
La cuve modélise une canalisation exposée au Soleil, où circule l’eau d’une piscine que
l’on souhaite réchauffer. L’eau entre dans la canalisation à 20 °C et on désire qu’elle en
sorte à 32 °C.
4 . Quelle serait la masse d’eau dont on pourrait élever la température de 20 °C à 32°C
en 1 seconde, grâce à toute l’énergie reçue par rayonnement par la surface exposée au
Soleil ? (1,5 pts)
5 . En déduire en kg.s-1, puis en L.h-1 le débit de l’eau dans la canalisation. (1 pt)
Données : capacité thermique massique de l’eau : c = 4,18 kJ.°C-1.kg-1.
Masse volumique de l’eau :
eau = 103 kg.m-3

L
Schéma n°1
Schéma n°2 Schéma n°3
ANNEXE - Compo 2 - 1S4
12 février 2009
Nom : __________________
 6
6
1
/
6
100%