Patrick Mac Farlane

Patrick Mac Farlane
Présenté à Pierre Pichet
UQAM
6 mai 1999

Introduction et théorie:
Que serait notre monde sans les enzymes? Nous ne pourrions pas boire un bon vin ou une
bonne bière, car sans les enzymes on aurait pas d’alcool. Les enzymes sont partout. Sans elles
il n’y aurait même pas de vie. Les enzymes servent à catalyser des réactions chimiques et
biochimiques. Pour vivre nous faisons appel à plusieurs de ses réactions. En effet, un bon
nombre de réactions biochimiques, importante à la survie de l’être vivant, se feraient trop
lentement. Étant donné que le corps vivant doit fonctionner à une température de 37ocelcius
(310,15 K) on ne peut pas augmenter la température pour accélérer la vitesse des réactions,
donc nous faisons appel aux enzymes. Lorsqu’une enzyme catalyse une réaction elle n’y
participe pas stoichimiquement, en d’autres mots elle n’est consumée. Ceci veut dire qu’elle
n’affecte pas l’équilibre de réaction, elle ne fait qu’accélérer la vitesse à laquelle la réaction
va atteindre son équilibre. Pour accélérer une réaction les enzymes diminue la barrière entre
l’état de substrat et de transition ce qui diminue l’énergie de transition sans avoir d’effet sur
l’énergie libre ( delta Go). Il y a plusieurs applications chimique à la catalyse enzymatique
pour plus de renseignements cliquer ici.
Par exemple la glycolyse sert à dégrader le glucose en pyruvate et elle produit aussi de
l’énergie sous forme D’ATP. Dans cette réaction biochimique très importante il y a plusieurs
enzymes qui sont utilisées comme la glucokinase qui sert à transformer le glucose en
glucose 6-phosphate, après plusieurs réactions et une douzaines d’enzymes nous aurons du
pyruvate qui servira dans le cycle de Krebs et nous aurons aussi de l’énergie sous forme
d’ATP ( lien cycle de Krebs). De plus, certaines enzymes aident à prévenir les cancers. Deux
de ces enzymes font parties de la catégorie des hydroperoxydases, leur nom sont : les
peroxydases et la catalase. Lorsqu’il y a une accumulation de peroxyde il peut y avoir
aboutissement à une génération de radicaux libres qui vont rompre les membranes. Cette
rupture de membrane peut causer le cancer et l’athérosclérose. Les hydroperoxydases protège
l’organisme contre le cancer en transformant les peroxydes nocifs en eau.(Harper, 1995)

La peroxydase est une enzyme surtout retrouvée dans le règne végétale.
Cependant elle ce retrouve aussi dans le lait, les leucocytes, les plaquettes et dans d’autres
tissus engagés dans le métabolisme des eicosanoïdes (composés dérivés d’acides gras
polyénoïques, eicosa-(20C) , ils comprennent les prostanoïdes et les leucotriènes).
Il y a plusieurs applications de la peroxydase dans le monde de la science. L’intérêt majeur des peroxydase est la
catalyse par cette dernière pour la production de radicaux libres qui participent à plusieurs réactions post-
enzymatiques. Les peroxydases sont aussi utilisées dans les processus de décolorations grâce à leur pouvoir
oxydatif. De plus, les peroxydases sont utilisées dans les colorants alimentaires et comme modificateurs de
couleur dans les jus, les vins, les thés ainsi que de comme teintures dans l’industrie du parfum et les processus
photographiques.
Pour des renseignements sur d’autre applications de la peroxydase cliquer ici.
Au cour de la réaction catalysé par la peroxydase , le peroxyde d’hydrogène est réduit aux
dépens de plusieurs substances comme l’ascorbate, le cytochrome c et les quinones. Ces
derniers agissent comme accepteurs d’électrons. Voici la réaction globale
AH2= phénols, aryl et alkyl (amines)
Dans les globules rouges il y a destruction du peroxyde d’hydrogène et des hydroperoxydes
lipidiques à l’aide de la glutathion peroxydase, enzyme contant de sélénium comme groupe
prosthétique. Cette réaction protège les lipides membranaires et l’hémoglobine contre
l’oxydation par les peroxydes. Ceci est fait par la glutathion réduit. (Harper, 1995)
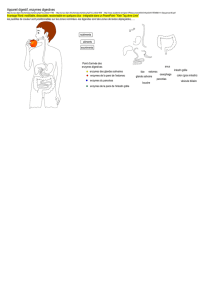
La catalase est une hémoprotéine. Elle est présente dans la moelle osseuse, les
muqueuses, les reins, le sang et le foie. Cette enzyme possède une activité peroxydasique et
est capable d’utiliser une molécule de H2O2 comme substrat donneur d’électron et en même
temps une autre molécule de H2O2 comme accepteur d’électrons.
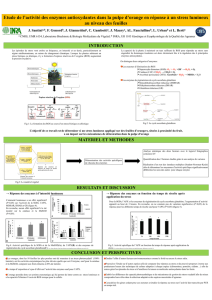
Le rôle de la catalase est de détruire leH2O2 formé par l’action des oxydases. Le foie et
plusieurs autres tissus contiennent des peroxysomes, ceux-ci sont riches en oxydases et en
H2O2 + AH2 2H2O + A
pexoxydase
2H2O2
Catalase 2H2O +O2

peroxydases. Ceci démontre qu’il est avantageux de regrouper les enzymes qui produisent le
H2O2 ainsi que les enzymes qui le détruisent. De plus, les systèmes mitochondriales et
microsomiques doivent être considérés comme des sources de H2O2.
Voici le rôle de la catalase dans la destruction du peroxydes d’hydrogène sous forme de formule :
h Stevens, Chimie des Solution
O2 H2O2 catalase 2H2o
AH2
AH2
H2O2 O2
A
1
/
4
100%