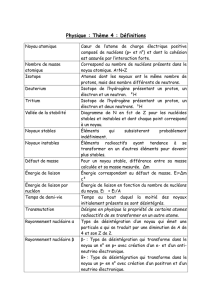
Décroissance Radioactive

Chap. 4 Décroissance radioactive
I. Le noyau atomique
1- Composition du noyau
On représente un noyau atomique par
X est le symbole chimique de l'élément
Z est nombre de charge ou nombre de protons du noyau
A est le nombre de masse ou nombre de nucléons
A - Z donne le nombre de neutrons
Le noyau est constitué de nucléons : Protons et neutrons
Un nucléide est un ensemble de noyaux caractérisés par la même valeur de A et de Z
Al
27
13
: 13 protons et 14 neutrons
2- Isotopes
On dit que deux noyaux sont isotopes s'ils ont le même nombre de charge mais des nombres de
masse différents. même Z mais A différent
O
16
8
99,76 % ;
O
17
8
0,04 % ;
O
18
8
0,2 %
3- Unité de masse atomique
L'atome est très léger, aussi l'emploi du kilogramme est peu pratique.
Nous utiliserons à l'échelle atomique l'unité de masse atomique.
L'unité de masse atomique est égale au douzième de la masse d'un atome de l'isotope 12 du carbone.
4- Stabilité du noyau
Dans un noyau atomique, il y a les forces d’interactions électriques répulsives entre les protons. Les
forces d’interactions gravitationnelles entre les nucléons ont des valeurs très faible devant celles des
forces électrique car les masses sont petites.
La cohésion des noyaux stables est assurée par l’interaction forte (attractive) de très courte portée
entre les nucléons (de l’ordre de 10-15 m).
Le diagramme de Ségré permet de voir la répartition des noyaux stables parmi les quelques 1500
nucléides connus. (seuls 274 sont stables). Voir p84 et 85 Hachette
A
Z
1 u = 1 M = 1 12 . 10-3 = 1,6605402 . 10-27 kg
12 N 12 6,0221367 . 1023
nucléons
proton
neutron
électron
charge (C)
+1,60217733.10-19
0
-1,60217733.10-19
masse (kg)
1,6726231.10-27
1,6749286.10-27
9,1093897.10-31
masse (u)
1,0073
1,0087
0,55 . 10-3

II. La radioactivité
1- Définition
Les noyaux radioactifs sont des noyaux instables. Au bout d'une certaine durée, i se transforme en
un autre noyau, il se désintègre. Cette désintégration s'accompagne généralement d'un rayonnement
dangereux pour l'homme.
La radioactivité est la transformation spontanée d'un noyau en un autre accompagnée de l'émission
d'un rayonnement radioactif.
Lors de la désintégration radioactive le noyau père se transforme en un noyau fils et il y a en même
temps création de rayonnements invisibles.
Il y a quatre types de rayonnement : , +, - et .
2- Lois de conservation
Lors des radioactivités et le noyau père X donne un noyau fils Y plus une particule chargée.
X
A
Z
Y
'A 'Z
+
P
a
z
Dans ces équations bilan il y a (loi de Soddy) :
- conservation du nombre de nucléons A = A' + a
- conservation de la charge électrique Z = Z' + z
3- La radioactivité
La radioactivité est l'émission de particules ou noyaux d'Hélium
He
4
2
par des noyaux instables.
La particule st positive.
X
A
Z
Y
4A 2Z
+
He
4
2
4- La radioactivité
-
Au cours de cette désintégration il y a émission d'électrons - (ou
e
0
1
) très rapides (270 000 km.s-1).
Elle est accompagnée de celle d'une particule appelée antineutrino
0
0
de charge nulle et de masse si
faible qu'elle n'a pas été encore mise en évidence.
X
A
Z
Y
A
1Z
+
e
0
1
+
provient de la décomposition d'un neutron en proton
n
1
0
p
1
1
+
e
0
1
+
5- La radioactivité
+
Ne concerne que les nucléides artificiels. Il y a émission d'un positron (masse de l'électron mais
charge électrique opposée)
e
0
1
. Elle s'accompagne généralement de l'émission d'un neutrino.
X
A
Z
Y
A
1Z
+ +
provient de la décomposition d'un proton en neutron
p
1
1
n
1
0
+
e
0
1
+
6- le rayonnement
A la suite de désintégrations nucléaires certains noyaux sont créés dans un état excité instable, il
possède un excédent d'énergie. Il devient stable en libérant cette énergie sous forme de rayonnement
qui ne sont pas des particules mais des radiations électromagnétiques se propageant à la vitesse de
la lumière c et dont les fréquences sont de l'ordre de 1020 Hz.

Ils sont très pénétrants (20 cm de plomb et plusieurs mètres de béton).
Généralement ce rayonnement sera écrit dans l'équation bilan
7- Famille radioactive
Le noyau fils obtenu par transformation radioactive d’un
noyau père, peut être lui-même radioactif, se désintégrer à
son tour.
Il existe trois familles radioactives dans la nature.
Uranium 238 – plomb 206
Uranium 235 – plomb 207
Uranium 232 – plomb 208
III. Loi de décroissance
1-Désintégration d’un noyau
Un noyau ne vieillit pas, il se transforme en un autre noyau d’un seul coup.
Un noyau instable peut revenir à tout moment à l’état stable, c’est une désintégration, qui est
imprévisible et aléatoire (sur un ensemble de noyaux on ne sait pas lesquels vont se désintégrer).
Il y a cependant une probabilité de désintégration qui est indépendante du temps et qui ne dépend
que du nucléide.
2- Evolution du nombre de noyaux radioactifs
La loi de décroissance des noyaux radioactifs a été établie expérimentalement en 1902 par
Rutherford et Soddy.
Définition : Le nombre, dN, de désintégrations nucléaires spontanées qui se produisent dans une
quantité donnée de matière pendant un temps infiniment petit, dt, est proportionnel au nombre
d'atomes radioactifs (N) et au temps (dt) selon la relation :
dN = - . N . dt (1)
où est la constante radioactive et c'est une caractéristique du radionucléide.
Par intégration, on obtient : Nt = N0 . e(- . t) (2)
où : N0 est le nombre d'atomes radioactifs présents à l'instant initial
Nt est le nombre d'atomes radioactifs présent à l'instant t
A A'
X - + Y*
Z + Z'
A' A'
Y* + Y
Z' Z'
A A'
X - + Y* +
Z + Z'

3- Demi vie ou période radioactive :
La demi vie (période radioactive) d'un radionucléide, t½ ou T, est le temps nécessaire pour que la
moitié des atomes radioactifs présents initialement se soient désintégrés.
Au bout d'un temps t correspondant à une période, t½ ou T, on a donc : NT = N0 / 2 = N0 . e(- . T)
soit : . T = Ln 2
et donc : T = 0,693 / (3)
La période radioactive d'un radionucléide est une caractéristique de celui-ci et sa valeur est
extrêmement variable :
exemple : 21284Po (polonium) = 0,3 10-6 seconde
23290 (thorium) = 1,4 1010 ans
4- Activité
L'activité A d'un radionucléide est le nombre de désintégrations qui se produisent par unité de temps
dans une quantité donnée de ce radionucléide.
L'activité représente donc la vitesse de désintégration du radionucléide : A = - dN / dt
Compte tenu des relations (1) et (2), on obtient : A = . N = (0,693 / T) . N (4)
On peut ainsi montrer que : At = A0 . e(- . t) (5)
Donc l'activité diminue de moitié au bout d'une période.
L'unité est le BECQUEREL (Bq): 1 Bq = 1 désintégration par seconde
L'ancienne unité encore très utilisée est le Curie (Ci): 1 Ci = 3,7 1010 Bq
5- La relation masse - activité
D'après la définition de l'activité, on peut dire que : une activité de 1 Bq est l'activité d'une quantité
de radionucléide dans laquelle le nombre moyen de désintégrations par seconde est égal à 1.
La masse molaire M d'un radionucléide est la masse de NA atomes où NA = nombre d'Avogadro =
6,02 1023 ;
La masse m de N atomes correspondant à une activité A, est :
A
NN.M
m
Et d'après la relation : A = . N = (0,693 / T) . N (4)
693,0 T
A
N
M
m
A
= 0,24 10-23 . M . A . T avec : m et M sont exprimés en gramme
A en Bq et T en seconde
Donc, la masse de radionucléide correspondant à une activité donnée est d'autant plus grande que :
la période du radionucléide est longue sa masse molaire est élevée
6- Constante de temps
La durée =
1
est appelée constante de temps. Elle est telle que A() = N0 . e(- . ) =
e
N0
IV Applications
1- Datation en géologie
Le produit de désintégration ultime de l'uranium 238 (période de 4,47 milliards d'années) est le
plomb 206 stable. Il est donc possible de déterminer l'âge des roches anciennes par la mesure du
rapport de la teneur de ces roches en plomb 206 à celle en uranium 238.
Une roche contient d'autant plus de plomb qu'elle est âgée.

D'autres couples, tels le couple rubidium 87 (période de 48,9 milliards d'années) et le strontium 87
(qui est stable), sont utilisés. L'âge de la Terre a été ainsi estimé à 4,55 milliards d'années.
2- Datation en archéologie
La méthode de datation au carbone 14.
Les 3 principaux isotopes naturels du carbone sont :
Isotope
C
12
6
C
13
6
C
14
6
Propriétés
stable
stable
radioactif
Abondance
98,89 %
1,11 %
0,0000000001 %
Période
5730 ans
En conséquence, dans les organismes vivants, il existe 1 atome de carbone 14 pour 1012 atomes de
carbone 12. L’isotope 14 du carbone est formé dans la haute atmosphère via les radiations des
neutrons cosmiques sur l'azote 14 selon la réaction :
N
14
7
+ 10 n --->
C
14
6
+ 11 p
Le carbone 14est rapidement oxydé en
2
14
6CO
et intègre le cycle cellulaire via la photosynthèse
(plante) et l'alimentation (animaux) ; ainsi les organismes vivants échangent du carbone 12 contre
du carbone 14 tout au long de leur existence. La proportion de cet isotope chez les organismes
vivants est à peu prés équivalente à celle détectée dans l'atmosphère ; quand les organismes
meurent, l'échange est arrêté et le stock de carbone 14 commence à décroître selon la période de cet
isotope.
La méthode de datation au carbone 14 repose donc sur la vitesse de décroissance de cet isotope. En
effectuant le rapport (
C
14
6
/
C
12
6
), on peut dater la mort de l'organisme : moins la teneur en
C
14
6
est
élevée, plus la date de la mort est ancienne. Par cette méthode, on peut dater des matériaux
remontant à -40.000 ans.
3- Effets biologiques
Un radionucléide ayant pénétré dans l'organisme peut soit :
- se répartir de façon homogène dans tout l'organisme, par exemple : tritium, 24Na, 36Cl;
- soit se concentrer dans un ou plusieurs organes cibles, par exemple : 131I dans la thyroïde.
Dans le second cas, l'élimination de l'activité incorporée s'effectue par la combinaison de la
décroissance radioactive du radionucléide et de l'élimination biologique propre à l'organe cible. En
première approximation, on peut considérer que l'élimination biologique obéit à une loi
exponentielle de période biologique Tb, qui est le temps nécessaire pour que la moitié de la quantité
d'une substance introduite dans un organe en soit éliminée.
La loi globale peut alors s'écrire :
t)
T2ln
T2ln
(
0b
eAA
Et l'on définit une période effective, Te :
be T
1
T
1
T
1
Le tableau suivant illustre cette notion de période effective :
Radionucléide
Organe cible
T
Tb
Te
H
3
1
organisme entier
12 ans
10 jours
10 jours
I
131
53
thyroïde
8 jours
140 jours
7,6 jours
Pu
239
94
os
24400 ans
200 ans
200 ans
1
/
5
100%