corrigé - WordPress.com

Module 1 – Les réactions chimiques
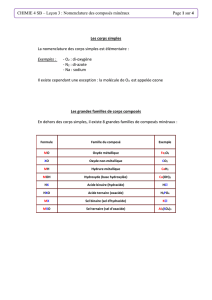
1.1 : La nomenclature des composés inorganiques
Tableau des nombres d’oxydation
H
Li
C
N
O
F
Na
Mg
Al
Cl
K
Ca
Éléments de transition
Br
Les nombres d’oxydation des
éléments de transition varient. Il faut
les indiquer en chiffres romains
lorsqu’on nomme les substances, sauf
argent et zinc qui sont toujours Ag+,
Zn2+.
électrons de valence
L’écriture de formules chimiques
1. Tu écris les symboles des éléments avec leur nombre d’oxydation. Le
cation est en avant.
2. Tu trouves le plus petit rapport entre les nombres d’oxydation en
négligeant les signes + et -.
3. Tu ajoutes des indices pour équilibrer les charges; le total doit être
égal à zéro. Indice: Chiffre écrit au coin inférieur droit du symbole.
Exemples: K et O = K2O H et CO3 = H2CO3
Al et Cl = Al2(SO4)3
Nomenclature

Pour les éléments de transition (sauf pour Ag et Zn), vous devez
inclure un chiffre romain lorsque vous nommez la substance pour
indiquer le degré d’oxydation de l’élément.
Ex : FeCl3 : chlorure de fer III
Ni(OH)2 : hydroxyde de nickel II
Composés sans oxygène :
Ceux dans l’eau (aq = aqueux) :
A) acides binaires (hydracides)
Hydrogène et non-métal (aq)
On les nomme : acide (non-métal) hydrique
Exemple : HF (aq) Acide fluorhydrique
***soufre = sulf________ azote = nitr________ phosphore = phosph___________ ***
Symboles composés noms
H et F
HF
Acide fluorhydrique
H et Cl
HCl
Acide chlorhydrique
H et Br
HBr
Acide Bromhydrique
H et I
HI
Acide Iodhydrique
H et S
H2S
Acide sulfhydrique
H et P
H3P
Acide phosphydrique
H et CN
HCN
Acide cyanhydrique
Ceux sans eau :

B) sels binaires
1- Hydrogène et non-métal
On les nomme : (non-métal) ure d’hydrogène
Exemple : HF Fluorure d’hydrogène
Symboles composés noms
H et F
HF
Fluorure d’hydrogène
H et Cl
HCl
Chlorure d’hydrogène
H et Br
HBr
Bromure d’hydrogène
H et I
HI
Iodure d’hydrogène
H et S
H2S
Sulfure d’hydrogène
H et P
H3P
Phosphure d’hydrogène
H et CN
HCN
Cyanure d’hydrogène
2- Métal et non-métal
On les nomme : (non-métal) ure de (métal)
Exemple : NaCl Chlorure de sodium
Symboles composés noms
NH4 et S
(NH4)2 S
Sulfure d’ammonium
Al et Cl
AlCl3
Chlorure d’aluminium
Al et S
Al2S3
Sulfure d’aluminium
Fer(II) et Cl
FeCl2
Chlorure de fer (II)
K et CN
KCN
Cyanure de potassium
Mg et N
Mg3N2
Nitrure de magnésium
C) Les hydrures : Métal et hydrogène

On les nomme : hydrure de (métal)
Exemple : NaH hydrure de sodium
Symboles composés noms
Li et H
LiH
Hydrure de lithium
K et H
KH
Hydrure de potassium
Mg et H
MgH2
Hydrure de magnésium
Al et H
AlH3
Hydrure d’aluminium
D) Les composés covalents
Un composé covalent est constitué de deux non-métaux (ou métalloïdes) qui se
partagent des électrons.
Ex : PCl3 trichlorure de phosphore
ClF3 trifluorure de chlore
CCl4 tetrachlorure de carbone
Composés avec oxygène
A) Base : Composés qui renferment un ion métallique et l’ion négatif
hydroxyde (OH)-
Métal et OH
On les nomme : hydroxyde de (métal)
Ex : KOH : hydroxyde de potassium
Ex : Ca et OH formule : Ca(OH)2 nom : Hydroxyde de calcium
Ex : hydroxyde de fer III formule : Fe(OH)3
B) Oxydes : composés binaires formés d’oxygène et d’un autre élément

1) Oxydes métalliques : Métal et oxygène
On les nomme : oxyde de (métal)
Ex : K2O : oxyde de potassium
Ex : Al et O nom : Oxyde d’aluminium
Ex : oxyde de fer III formule : Fe2O3
2) Oxydes non-métalliques : Non-métal et oxygène
On les nomme : (préfixe) oxyde de (préfixe autre que 1)(non-métal)
Ex : CO2 : Dioxyde de carbone
Ex : SO3 : trioxyde de souffre
Ex : pentoxyde de dichlore formule : Cl2O5
Ex : N2O6 : hexoxyde de diazote
Préfixes pour le nombre d’atomes d’oxygène :
1
Mono-
5
Pent-
2
Di-
6
Hex-
3
Tri-
7
Hept-
4
Tétr-
8
Oct-
3) Les peroxydes
Un peroxyde est une substance renfermant l’ion polyatomique O22-.
Chaque atome d’oxygène possède un nombre d’oxydation de 1-.
Forme des liaisons avec groupes 1 et 2 seulement.
Règle de nomenclature : peroxyde + de (ou d’) + nom de l’ion positif
Ex : H2O2 peroxyde d’hydrogène
Na2O2 peroxyde de sodium
MgO2 peroxyde de magnésium
1
/
5
100%