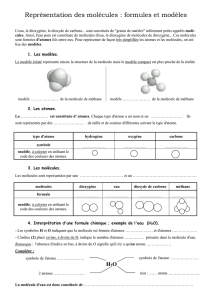
I/ Les atomes

Chap 12 : les transformations chimiques
I/ Les atomes
Voir activité I
Bilan :
Un atome est un petit grain de matière que l'on va représenter par une sphère. Il en
existe une centaine de différents. On les symbolise par une lettre majuscule (exemple O
pour l'oxygène) ou par deux lettres : une majuscule suivie d'une minuscule (exemple :
Cu pour le cuivre)
Symboles à connaître : H pour l'hydrogène, C pour le carbone et O pour l'oxygène.
Toute la matière présente dans l'Univers est en fait un assemblage d'atomes
Un atome est minuscule : sa taille est d'environ 0,0000000001 m !!
II/ Les molécules
Voir activité II
Bilan :
Une molécule est en fait un assemblage d'atomes. Les molécules d'un corps pur sont
toutes identiques (exemple : toutes les molécules d'eau sont constituées des mêmes
atomes, dans les mêmes proportions)
Une molécule est représentée par une formule :
1) on écrit l'un à côté de l'autre les symboles des atomes qui la constituent, dans l'ordre
alphabétique,
2) on marque en indice (en bas à droite) de chaque symbole en quelle quantité cette
atome est présent dans la molécule. On n'écrit jamais le chiffre 1
Formules de molécules à connaître :
1) l'eau contient 2 atomes d'hydrogène et 1 de carbone : on écrit HO puis on met en
indice les quantités : H2O
2) Autres formules à connaître : dioxyde de carbone CO2, méthane CH4, butane C4H10,
dioxygène O2
III/ Les transformations chimiques
Voir activité III
Bilan :
Lors d'une transformation chimique (combustion par exemple), il y a un réarrangement
des atomes des réactifs : ceux-ci disparaissent et de nouvelles molécules (les produits)
apparaissent...
Il y a donc autant d'atomes avant et après la transformation : seule la façon dont sont
assemblés les atomes change. La masse totale ne varie donc pas au cours d'une
transformation chimique.

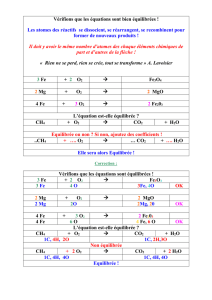
IV/ équations de réaction
Bilan :
On représente les transformations chimiques par des équations de réaction qui indiquent
les réactifs, les produits, le sens de la transformation, et les proportions des différentes
molécules
Pour écrire une équation, on marque à gauche d'une flèche les réactifs séparés par un +,
et à droite les produits, eux aussi séparés par un plus. Par exemple, la combustion du
méthane (CH4) dans le dioxygène (O2) produit de l'eau (H2O) et du dioxyde de carbone
(CO2).
On écrit donc CH4 + O2 → H2O + CO2
On vérifie ensuite qu'il y bien autant d'atomes avant et après la réaction :
Carbone : 1 avant et 1 après : c'est bon
Oxygène : 2 avant et 3 après : problème car un atome d'oxygène ne peut être crée au
cours de la combustion...
Hydrogène : 4 avant et 2 après : problème également car les atomes d'hydrogène ne
disparaissent pas au cours de la combustion
Pour résoudre cela, il suffit de comprendre que la transformation chimique n'a pas
conduit à l'apparition d'une molécule d'eau mais de 2. On écrit donc :
CH4 + O2 → H2O + H2O + CO2
On factorise comme en math :
CH4 + O2 → 2 H2O + CO2
On voit que l'on a désormais 4 H à gauche et 4 à droite : c'est bon
On recompte l'oxygène : 2 à gauche et 4 à droite. Cela signifie qu'il n'y a pas qu'une
molécule de dioxygène qui a réagit avc le méthane mais deux !! On écrit donc :
CH4 + O2 + O2 → 2 H2O + CO2
On factorise comme en math :
CH4 + 2 O2 → 2 H2O + CO2
Ceci est l'équation de la réaction de combustion du méthane
ATTENTION : une erreur classique consiste à modifier la formule d'une molécule
pour arriver au même nombre d'atome avant et après transformation chimique.
Ici par exemple ce serait écrire H4O au lieu de 2 H2O. Or H4O n'est pas de
l'eau et je sais que cette transformation produit de l'eau (apparition de buée) : je
suis donc obligé de laisser la formule H2O dans l'équation de la réaction : je joue
par contre sur le nombre de molécules qui apparaissent (ici 2 au lieu d'une...)
1
/
2
100%