Les interactions fondamentales élèves

1 S
LES INTERACTIONS FONDAMENTALES
P 2
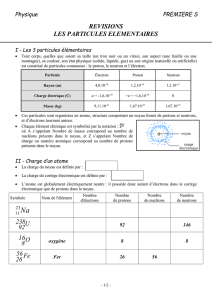
1. Les particules élémentaires
Dans l’Univers, la matière se présente sous des formes très diverses (noyaux, atomes, molécules, ions,
phases condensées ou gazeuses, organismes vivants, systèmes astronomiques…). Elle résulte de
l’arrangement de trois particules élémentaires de bases : l’électron, le proton et le neutron.
(Les protons et les neutrons sont constitués chacun de 3 quarks mais seront considérés au lycée comme des
particules élémentaires.)
1.1. Les particules élémentaires
L’électron est une particule élémentaire de masse
e
m
et de charge électrique négative qe=-e où e est la
charge élémentaire.
Le proton est une particule de masse
p
m
et de charge électrique positive
p
qe
.
Le neutron est une particule de masse
n
m
et de charge électrique nulle. La masse du neutron est
proche de celle du proton.
Masse
Charge
Le coulomb, de symbole C,
est l'unité de charge électrique
dans le système international
(S.I.).
Électron
kg109,1m 13
e
C101,6q 19
e
Proton
27 27
p
m 1,6726231 10 kg 1,67 10 kg
C101,6q 19
p
neutron
27 27
n
m 1,674929 10 kg 1,67 10 kg
0qn
La charge élémentaire :
L'électron porte la plus petite charge électrique existante dans l'état actuel de nos connaissances. On la
considère comme indivisible et on l'appelle charge élémentaire.
Une charge électrique est toujours un ………… de la valeur de la charge élémentaire notée
C101,6e 19
.
Comparaison des masses d'un nucléon et d'un électron :
p
e
m
m
1.2. L'atome et le noyau
Dans un atome, les protons et les neutrons sont localisés dans le noyau, les électrons sont en mouvement
autour du noyau. Les protons et les neutrons sont appelés les nucléons.
Le noyau d'un atome de symbole X est représenté par avec :
A le nombre de …………………
Z le nombre de charge ou numéro atomique correspondant au nombre de…………………
N = A – Z le nombre de …………………..
L'atome est électriquement neutre.
Le diamètre d'un atome est de l'ordre de……………..., celui du noyau est de l'ordre de……………….
On appelle élément chimique l'ensemble des particules caractérisées par ……………………………
On appelle isotope les éléments chimiques dont les noyaux ont ………………………………………
……….……………….……………………… (Z est le même mais A est différent,
C
12
6
;
C
13
6
;
C
14
6
).
La masse d'un atome est pratiquement égale à la masse de son noyau.

Applications :
1°/ Le rayon d’un atome d’or est 0,144 nm. Le symbole de l’unique isotope de l’or est
197
79 Au
.
1.1. Quelle est la masse approchée de l’atome d’or ?
1.2. Quelle est la masse volumique de l’atome d’or ?
1.3. Comparer cette valeur avec la masse volumique de l’eau.
1.4. Calculer la valeur de la charge portée par le noyau de l’atome.
2°/ Le noyau d’un atome porte une charge de
17
q 1,47 10 C
.
2.1. Calculer le nombre de charges élémentaires qu’il contient. En déduire son numéro atomique Z.
2.2. Quel est le nom de cet atome ?
2.3. Sachant que le nombre de nucléons est 238
2.3.1. Donner la composition du noyau de cet atome ;
2.3.2. Calculer la masse de cet atome en négligeant la masse des électrons ;
2.3.3. Calculer la masse d’une mole de cet atome.
1
/
2
100%