Les molécules en TS

.TP n°2 TP :T S
Chimie
Les Molécules
n°1
I) Objectifs
- Apprendre à nommer un composé organique.
- Utiliser les règles de nomenclatures.
- S’approprier les différentes formules et la représentation de CRAM.
- S’approprier la notion d’isomérie.
- Utiliser un logiciel Symyx Draw pouvant créer des molécules organiques et les nommer.
II) Remarques
Les molécules étudiées ci-dessous peuvent être visualisées à l’aide
- - de la boîte de modèles moléculaires;
- - du logiciel Symyx Draw
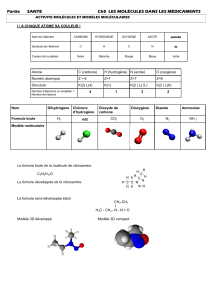
III) Isomérie des alcanes et représentation de CRAM.
1) Ecrire la formule brute, développée et semi-développée du méthylpropane.
2) La fabriquer avec les modèles ou le logiciel.
3) Positionner la molécule de façon à pouvoir la dessiner en représentation de Cram.
4) Vérifier, à l’aide du modèle moléculaire, qu’il y a libre rotation autour des liaisons C - C.
5) Construire, à l’aide de la boîte de modèles moléculaires, un isomère du méthylpropane.
6) Vérifier que les deux molécules ne sont pas superposables. De quel type d’isomérie s’agit-il ?
7) Ecrire la représentation topologique de cet isomère du méthylpropane.
IV) Les molécules de TS
1) La formule semi-développée d’une molécule à partir de son nom.
Identifier les fonctions présentes (couleurs différentes), la famille à laquelle elles appartiennent
Nom
Formule semi-développée
Famille
4-méthylhexan-3-ol
3-éthyl-2,3-diméthylheptanal
3,3,4-triméthylpentan-2-one
2-méthylpropan-2-amine
2-éthylpentanoate de butyle
4-éthyl-2-méthylhexan-3-one
4-méthylpent-2-ène
3-éthylpentanal
3-méthylpentan-2-one
Acide 3-méthylbutanoïque
N-éthyl-butan-1-amine
propanamide
4-methylpentan-2-ol

2) Le nom de la molécule à partir de la formule semi-développée ou de la formule topologique
Formule
Nom IUCPA
Famille

V) Géométrie et isomérie des alcènes.
1) Soit un alcène comptant n atomes de carbone. Donner la formule brute générale des alcènes.
2) Exprimer la masse molaire en fonction de n (nombre d’atomes de carbone) et des masses molaires atomiques de
l’hydrogène et du carbone.
3) Données MH = 1,00 g.mol-1; MC = 12,0 g.mol-1; MO = 16,0 g.mol-1.
4) On considère un alcène qui a une masse molaire M = 56,0 g.mol-1. En déduire la valeur de n et la formule brute
de l’alcène.
5) Nommer puis donner la formule semi-développée de tous les alcènes ayant cette formule brute.
6) Existe-t-il d’autres isomères appartenant à une autre famille ? Donner deux exemples. De quel type d’isomérie
s’agit-il ?
7) Construire la molécule de méthylpropène.
8) Vérifier, à l’aide du modèle moléculaire, que la rotation autour de la liaison C=C est impossible.
9) Donner la géométrie autour de chacun des atomes de carbone constituant la molécule. Justifier cette géométrie
pour chacun d’eux.
10) Construire, à l’aide du modèle moléculaire, le ou les modèles éclatés correspondants au but-2-ène.
11) Comparer les deux modèles éclatés obtenus pour le but-2-ène. Sont-ils superposables ? En quoi diffèrent-ils ?
12) Quel est le type d’isomérie mis en jeu ? Cette isomérie est-elle une isomérie de constitution ? Justifier ?
13) Dessiner les deux composés obtenus formule semi-développée. Donner un nom à chacun des deux composés.
VI) D’autres isoméries
L’analyse qualitative d’une molécule organique A de masse molaire 60,0 g.mol-1 montre que celle-ci possède la
composition massique suivante: C : 60,0 %; H : 13,33 %; O : 26,67 %
1) Déterminer la formule brute de A.
2) Etablir les formules semi-développées et les nommer des molécules organiques de formule brute A.
3) Entourez et nommez les groupes caractéristiques. Précisez la famille.
1
/
3
100%