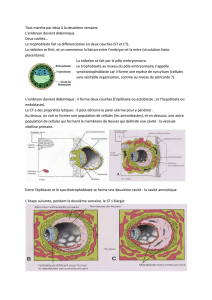
Week1

1
Embryogenèse précoce
De l’ovulation à l’implantation (première semaine du développement)
Ovulation, fécondation et implantation
Avant l’ovulation, sous l’influence des hormones hypophysaires FSH et LH, le follicule de "de
Graaf" augmente rapidement de taille. Une voussure apparaît à la surface de l’ovaire et porte à
son apex un spot avasculaire appelé stigma. Lors de l'ovulation, le follicule éclate, libérant
l’ovocyte entouré des cellules granuleuses du cumulus oophorus, qui se ré-arrangent pour former
la corona radiata. En parallèle, l’ovocyte achève la méiose I et commence la méiose II.

2
Le corps jaune
Après l’ovulation, la granulosa et la thèque interne du follicule rompu sont vascularisées et leurs
cellules prennent un aspect polygonal. Sous l’influence de LH, elles se chargent de pigment
jaunâtre et deviennent les cellules lutéales du corps jaune, responsables de la sécrétion de
progestérone. En synergie avec les oestrogènes, cette dernière induit la transformation sécrétoire
de l’endomètre, préalable à une éventuelle implantation de l’œuf.
Le transport de l’ovocyte
Avant la fécondation, les ramifications de l’oviducte couvrent la surface de l’ovaire et l’oviducte
se contracte de manière rythmique. On pense que ces contractions et les battements ciliaires de la
muqueuse aident la progression de l’œuf. Dans le tube, les cellules de la granulosa se détachent et
l’œuf est uniquement entouré de la ZP. L’œuf atteint la lumière utérine en 3-4 jour
Corpus albicans et corps jaune de grossesse
En absence de fécondation, le corps jaune atteint son développement maximal après 9 jours, puis
il dégénère progressivement et laisse place à une cicatrice fibreuse appelée corpus albicans. La
production de progestérone diminue, ce qui induit la menstruation. Si l’ovocyte est fertilisé, le
corps jaune se maintient par l’action de la gonadotropine chorionique (hCG) sécrétée par le
trophoblaste embryonnaire. Il augmente de taille et devient le corps jaune de la grossesse. Les
cellules lutéales continuent de produire de la progestérone jusqu’à la fin du 4ième mois, avant de
régresser progressivement alors que la production de progestérone est prise en charge par le
placenta. L’ablation du corps jaune avant le 4ième mois induit l’avortement.
La fertilisation ou fécondation
La fertilisation ou fécondation, c’est-à-dire la fusion des gamètes mâle et femelle, se produit dans
l’ampoule tubaire. Les spermatozoïdes et l’ovocyte restent viables dans le tractus génital féminin
pendant environ 24 heures. A leur arrivée dans les voies génitales féminines, les spermatozoïdes
ne sont pas fécondants, mais doivent subir une capacitation, qui prend environ 7 heures et
consiste en une dilution du sperme avec détachement de protéines et glycoprotéines qui tapissent
sa membrane plasmique. La réaction acrosomiale se produit après attachement à la zona pellucida

3
et est induite par des protéines de la zona. Cette réaction induit la libération d’enzymes de
l’acrosome, telles que l’acrosine et des protéinases de type trypsine, nécessaires à la pénétration
de la zona. On distingue trois phases dans la fécondation : pénétration de la corona radiata ;
pénétration de la zona pellucida ; et fusion des membranes du spermatozoïde et de l’ovocyte.
Parmi les 200 à 300 millions de spermatozoïdes éjaculés, environ 300 à 500 parviennent au site
de fertilisation. Les spermatozoïdes capacités traversent librement la corona radiata. La zona
pellucida (ZP) est une coque de glycoprotéines qui fixe les spermatozoïdes (grâce en particulier à
la protéine ZP3) et induit la réaction acrosomiale qui permet à un spermatozoïde de digérer
localement la ZP et de la traverser. Dès qu’un spermatozoïde est arrivé au contact de la
membrane de l’ovocyte, les grains du cortex de l’ovocyte libèrent des enzymes lysosomiales qui
modifient la ZP et la rendent imperméable à d’autres spermatozoïdes, ce qui assure que la
fécondation est réalisée par un seul d’entre eux. Dès que le spermatozoïde arrive au contact de
l’ovocyte, les membranes des deux cellules fusionnent et la tête et la queue du spermatozoïde
entrent dans le cytoplasme de l’ovocyte, abandonnant en surface la membrane. L’œuf répond à
l’entrée du spermatozoïde en déclenchant trois réactions. Premièrement, comme mentionné ci-
dessus, il se produit une réaction de dégranulation corticale qui fait suite à une légère
dépolarisation et à un courant entrant de calcium. Ensuite, l’ovocyte termine sa méiose II en
expulsant le second globule polaire et en formant le pronucleus féminin. Enfin, il se produit une
activation métabolique de l’œuf qui supporte les premiers stades du développement embryonnaire.
Le noyau du spermatozoïde migre à proximité du pronucléus féminin, et gonfle pour former le
pronucléus mâle. Les deux pronuclei répliquent leur ADN, puis perdent leur membrane pendant
que les chromosomes se condensent, se mélangent pour réaliser la première mitose de l’œuf
fécondé, avec production des deux premiers blastomères.

4

5
Les divisions cellulaires se poursuivent, mais la masse de cytoplasme de l’œuf original
n’augmente pas, de sorte que les cellules deviennent de plus en plus petites. Ces cellules,
appelées blastomères, forment la morula, en forme de mûre. Cette dernière se condense, et les
cellules les plus internes communiquent par des gap jonctions mais sont séparées des cellules
externes. Environ 3 jours après la fertilisation, on distingue la masse cellulaire interne (« inner
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%