Exercice 2 : Charge d`un condensateur

Devoir Commun Seconde Mai 2008 Physique - Chimie
___________________________________________________________________________
Lycée André Maurois – Bischwiller Page 1 / 5
DEVOIR COMMUN SECONDE
MAI 2008
EPREUVE DE
PHYSIQUE-CHIMIE
DUREE DE L’EPREUVE : 2H00
L’usage de la calculatrice est AUTORISE.
Ce sujet nécessite, en plus du matériel habituel, d’un rapporteur.
Ce sujet comporte deux exercices de PHYSIQUE et deux exercices de CHIMIE présentés sur
5 pages numérotées de 1 à 5, y compris celle-ci et la page de l’annexe.
Le candidat doit traiter tous les exercices, qui sont indépendants les uns des autres.
Exercice 1 : Le télescope spatial Hubble (4,5 points)
Exercice 2 : Réfraction de la lumière (5,5 points)
Exercice 3 : A propos de la bétadine (5 points)
Exercice 4 : A propos de l’élément chlore (5 points)

Devoir Commun Seconde Mai 2008 Physique - Chimie
___________________________________________________________________________
Lycée André Maurois – Bischwiller Page 2 / 5
Exercice 1 : Le télescope spatial Hubble (4,5 points)
Le télescope spatial Hubble, de masse m, a permis de faire d’importantes découvertes en
astronomie. Il évolue sur une orbite circulaire à 600 km d’altitude autour de la Terre.
1. Donner l’expression du poids du télescope Hubble.
2. Donner l’expression de la force d’attraction gravitationnelle exercée par la Terre sur le
télescope Hubble.
3. Montrer que si on identifie le poids du télescope et la force d’attraction gravitationnelle
exercée par la Terre sur ce dernier, l’intensité de la pesanteur g à l’altitude h s’écrit :
g =
Error!
Cette formule est valable pour tout l’exercice.
4. Calculer la valeur de l’intensité de la pesanteur g à l’altitude de Hubble.
5. Calculer la valeur de l’intensité de la pesanteur g au niveau du sol terrestre. La comparer à
celle de la question précédente.
6. Hubble a une masse m = 12 t. Calculer son poids à 600 km d’altitude.
7. Pourquoi Hubble ne tombe-t-il pas sur la Terre ?
Données : Masse de la Terre : MT = 5,98 . 1024 kg
Rayon de la Terre : RT = 6378 km
Constante de gravitation : G = 6,67 . 10-11 m3.kg-1.s-2
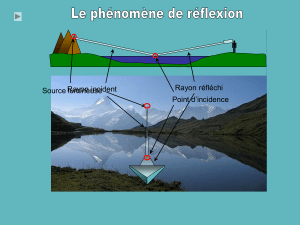
Exercice 2 : Réfraction de la lumière (5,5 points)
Un rayon de lumière monochromatique jaune rencontre la première face d’un bloc cubique
sous un angle d’incidence i1 tel que le trajet de la lumière dans le bloc soit comme indiqué sur
la figure 1 de l’annexe.
Pour cette lumière, l’indice de réfraction du verre est nJ = 1,732
1.1. Repérer l’angle de réfraction i2 en K dans le verre. Donner sa valeur en utilisant un
rapporteur.
1.2. Ecrire la relation exprimant la seconde loi de Descartes de la réfraction. En déduire la
valeur de l’angle d’incidence i1 en K dans l’air.
1.3. Représenter le rayon incident.
2. Déterminer la valeur de l’angle d’incidence iL et de l’angle de réfraction rL en L à la
sortie du bloc cubique. Justifier.
A présent, on envoie sur la première face du bloc, un rayon de lumière monochromatique
bleue avec un angle d’incidence iB de 60° en K et on mesure un angle de réfraction rB en K
égal à 29°.
3.1. Déterminer l’indice de réfraction du verre nB pour cette lumière monochromatique bleue.
3.2. Sachant que l’indice de réfraction d’un milieu est égal au rapport de la vitesse de la
lumière dans le vide sur la vitesse dans le milieu considéré, calculer la vitesse de la
lumière dans le cube pour la lumière monochromatique bleue.
3.3. Comment est la valeur de la vitesse de la lumière monochromatique jaune dans ce milieu
par rapport à celle de la lumière bleue ?
Donnée : Vitesse de la lumière dans le vide : c = 3,00 . 108 m.s-1
Exercice 3 : A propos de la bétadine (5 points)

Devoir Commun Seconde Mai 2008 Physique - Chimie
___________________________________________________________________________
Lycée André Maurois – Bischwiller Page 3 / 5
Les trois parties sont indépendantes.
La bétadine est un médicament utilisé comme antiseptique.
Il existe différentes espèces chimiques utilisées comme antiseptique :
- le diiode
- les ions permanganate
- les ions hypochlorite
- etc
Première partie
Afin de déterminer quelle espèce chimique est utilisée comme
antiseptique dans la bétadine, on réalise une chromatographie
sur couche mince.
On dépose sur une plaque :
- en A : du permanganate de potassium contenant des ions
permanganate
- en B : du diiode
- en C : une goutte de bétadine
Ci-contre, le chromatogramme obtenu.
I.1. D’après le chromatogramme obtenu :
- La bétadine est-elle un corps pur ? Justifier.
- Quelle espèce chimique joue le rôle d’antiseptique dans la bétadine ? Justifier.
I.2.1. Définir le rapport frontal Rf. De quoi dépend-t-il ?
I.2.2. A l’aide des données suivantes, déterminer quel éluant a été utilisé pour réaliser cette
chromatographie. Justifier.
éluant A
éluant B
Rf du diiode
0,35
0,60
Deuxième partie
On veut extraire le diiode de la bétadine qui est une solution aqueuse de diiode.
Données :
- Solubilité du diiode dans différents solvants :
Solvant
eau
alcool
éther
benzène
Solubilité du diiode en
g.L-1
0,3
250
250
140
- L’alcool est miscible à l’eau.
- L’éther et le benzène ne sont pas miscibles à l’eau.
II.1. Quel solvant faut-il utiliser pour extraire le diiode de la bétadine ? Justifier la réponse.
II.2. On verse la bétadine et le solvant choisi dans une ampoule à décanter ; on agite le
mélange puis on laisse reposer. On observe alors deux phases.
Sachant que la densité du solvant choisi est égal à 0,7 , schématiser l’ampoule à décanter
et les deux phases en précisant leurs constitutions. Justifier.
Troisième partie
front du solvant

Devoir Commun Seconde Mai 2008 Physique - Chimie
___________________________________________________________________________
Lycée André Maurois – Bischwiller Page 4 / 5
Pour réaliser le dépôt B de la chromatographie faite lors de la première partie, on a utilisé une
solution S d’eau iodée.
Pour préparer cette solution S, on a prélevé 10,0 mL d’une solution d’eau iodée à 0,050
mol.L-1, puis on a versé ces 10,0 mL dans une fiole jaugée de 50 mL que l’on a complétée
avec de l’eau distillée.
III.1. Quelle est la concentration de la solution S ainsi préparée ?
III.2. Expliquer les différentes étapes de la préparation de la solution S, en précisant
notamment le nom de la verrerie utilisée. On pourra s’aider de schémas légendés.
Exercice 4 : A propos de l’élément chlore (5 points)
Les données se trouvent à la fin de l’exercice.
Soit un atome de chlore Cl caractérisé par les nombres Z = 17 et A = 35.
1.1. Préciser sa composition et donner le symbole de son noyau.
1.2. On considère deux autres atomes caractérisés par les couples (Z, A) suivants (17, 36) et
(17, 37). Que peut-on dire de ces atomes ? De quel élément font-ils partie ? Justifier.
2.1. Donner la structure électronique d’un atome de chlore. Préciser le nombre d’électrons
externes.
2.2. A quelle colonne et à quelle famille de la classification périodique cet élément appartient-
il ?
2.3. Quel ion peut-il donner ? Justifier.
2.4. Combien de liaisons covalentes peut-il former ? Justifier.
3.1. Prévoir la composition de la molécule qu’il formera avec l’élément hydrogène (Z = 1).
3.2. Donner la représentation de Lewis de cette molécule.
L’élément chlore se présente naturellement comme corps simple sous forme de gaz dichlore
Cl2 dans les conditions normales de température et de pression.
4.1. Quelle est la quantité de matière contenue dans un échantillon de 89 g de ce gaz ?
4.2. Quel est le volume occupé par cet échantillon dans les conditions normales de
température et de pression ?
4.3. Ce gaz est très soluble dans l’eau, où il se dissout en restant à l’état moléculaire. Calculer
la concentration molaire en dichlore de la solution obtenue en dissolvant cet échantillon
dans l’eau, la solution finale ayant un volume de 750 mL.
Données :
- Volume molaire des gaz dans les conditions normales de température et de pression : Vm =
22,4 L.mol-1
- Masses molaires atomiques : M(H) = 1,0 g.mol-1 ; M(C) = 12,0 g.mol-1 ; M(Cl) = 35,5
g.mol-1 ;

Devoir Commun Seconde Mai 2008 Physique - Chimie
___________________________________________________________________________
Lycée André Maurois – Bischwiller Page 5 / 5
ANNEXE
Nom ou numéro d’identification :
Figure 1
Ne pas oublier de rendre l’annexe avec votre copie.
1
/
5
100%