Correction DS1.

Correction DS1.
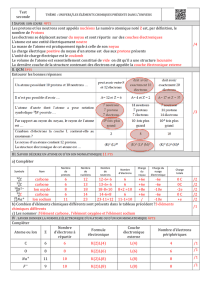
Exercice 1 : Élément inconnu.
N°
Réponses
Pts
A1
Les particules présentes dans le noyau sont les protons et les neutrons. Le proton porte une charge
électrique positive.
*
*
A2
La charge du noyau est due aux protons, le nombre de protons est Z=
=
. Le numéro
atomique est donc Z=16. Par ailleurs, ce noyau contient 16 neutrons donc il comporte au total
16+16=32 nucléons donc A=32.
*
*
*
A3
Cet atome possède 16 électrons car il possède 16 protons et qu’un atome étant électriquement neutre,
il doit posséder autant d’électrons que de protons.
*
*
B1
L’élément ayant le même numéro atomique mais possédant 18 neutrons correspond au même élément
car un élément est défini par son numéro atomique c'est-à-dire son nombre de protons.
*
*
B2
Ces deux composés sont appelés isotopes.
**
B3
Ces deux noyaux se représentent par
et
.
**
C1
Le fluor possède 9 protons donc 9 électrons. Sa structure électronique est donc K2L7.
Le lithium possède 3 protons donc 3 électrons. Sa structure électronique est donc K2L1.
**
C2
Le fluor possédant 7 électrons externes, il se trouve dans l’avant dernière colonne, c’est un halogène.
Le lithium possède 1 électrons externe il est donc dans la première colonne, c’est un alcalin.
**
C3
Le fluor pour respecter le règle de l’octet va gagner un électron pour former un ion négatif (anion) ce
sera l’ion F-.
Le lithium pour respecter la règle du duet va perdre 1 électron pour former un ion positif (cation) ce
sera l’ion Li+
**
Exercice 2 : Or.
N°
Réponses
Pts
1
L’essentiel de la masse de l’atome est concentrée dans son noyau.
**
2
La masse de l’atome d’or est égale à celle de son noyau qui est égale la masse de ses nucléons :
matomemnoyau=Amnucleon=1971,7.10-27=3,3.10-25kg.
**
*
3
Cette pépite contient
atomes d’or.
**
Exercice 3 : Éthanamide.
N°
Réponses
Pts
1
La formule brute de l’éthanamide est C2H5NO
***
2
L’atome de carbone forme quatre liaisons car sa structure électronique est K2L4, il lui manque donc 4
électrons pour saturer sa couche externe donc il formera quatre liaisons.
L’atome d’azote forme trois liaisons car sa structure électronique est K2L5, il lui manque donc 3
électrons pour saturer sa couche externe donc il formera trois liaisons.
**
**
3
**
**
4
***
1
/
1
100%