Spectres d`émission et d`absorption

15/04/2017 769774367 1/1
PHYSIQUE
SPECTRES D'EMISSION ET D'ABSORPTION
Chap.16
I. Les spectres d’émission
A. Dispersion de la lumière blanche par un prisme
Montage : lanterne /diaphragme / lentille / fente / prisme en verre / écran
Un prisme est placé sur le trajet de la lumière provenant d’une lampe à incandescence
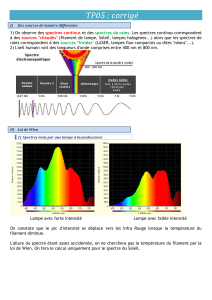
Observer et dessiner le spectre en indiquant les différentes couleurs
B. Dispersion de la lumière blanche par un réseau
Un réseau est constitué d'un film transparent sur lequel on a gravé des traits parallèles, équidistants et très fins
(exemple : le réseau noté : 580 : on a gravé 580 traits par millimètre).
Montage : lanterne / fente / réseau / écran
Observer et dessiner le spectre obtenu
C. Conclusions
1) Le réseau dévie-t-il davantage le rouge que le violet ? Comparez au spectre obtenu avec le prisme.
2) Quels sont les points communs et les différences entre les deux spectres ?
II. Spectres d’émission
Un spectre d’émission est un spectre produit par la lumière directement émise par une source
A. Analyse de la lumière émise par une lampe
Montage : brancher la lampe aux bornes du générateur hors tension (alimentation ajustable).
Régler la tension sur zéro puis mettre le générateur sous tension.
ATTENTION : NE PAS DEPASSER 6V.
Augmenter progressivement la tension tout en observant avec le spectroscope la lumière émise par la lampe.
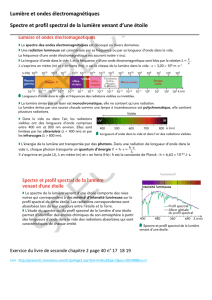
1) Quelle influence a la variation de tension sur la lampe ?
2) Quelle est la conséquence de cette variation sur les spectres observés ?
3) De quelle grandeur physique dépend ces changements ?
B. Spectres de raies
On analyse à l’aide du spectroscope la lumière émise par une lampe à vapeur de mercure puis une lampe à
vapeur de sodium.
La lampe à vapeur de mercure contient des atomes (Hg) de mercure sous faible pression. Ces atomes subissent
des décharges électriques et sont excités.
La lampe à vapeur de sodium contient des atomes de sodium (Na). Eux aussi subissent des décharges
électriques et sont excités.
1) Dessiner les spectres obtenus
2) Les spectres d’émission dépendent-ils de l’élément chimique utilisé ?
C. Spectre d’émission d’une lampe fluo compacte et d'un « néon »
Montage : Regarder une telle lampe au travers d’un réseau et d’une fente
1) Décrivez les spectres obtenus
2) Comment peut-on qualifier ces spectres ?
D. Les couleurs des flammes
On pulvérise sur une flamme non éclairante d’un bec Bunsen une solution contenant des ions sodium Na+.
L’expérience est reproduite avec d’autres solutions ioniques.
Observer le document en couleur sur votre table et noter dans l’ordre les éléments chimiques correspondants.
III. Les spectres d’absorption
Un spectre d’absorption est un spectre obtenu en analysant la lumière blanche qui a traversé une substance
A. Spectre de raies d’absorption
Voir le document 15 p 240 du livre
Décrire ce spectre.
B. Spectre de bande d’absorption
Montage : Placez une fente sur un rétroprojecteur. Poser dessus une cuve contenant une solution de
permanganate de potassium. Placez un réseau sur la lentille du rétroprojecteur
On analyse la lumière transmise à travers différentes solutions colorées
1) Pourquoi observe-t-on 2 spectres sur l’écran ?
2) L’un des spectres est celui de la solution de permanganate de potassium. Décrivez ce spectre
3) Pourquoi parle-t-on de spectre de bandes ?
4) Comment pouvez-vous expliquer la couleur de la solution à partir de son spectre d’absorption ?
5) Autres manipulations possibles : On observe le spectre du sulfate de cuivre et de l’hélianthine. Commentaires.
1
/
1
100%