LE PLACENTA PRAEVIA Morbidité néonatale et maternelle

1
Université d’Angers
UFR des sciences médicales
Ecole de sages-femmes RENE ROUCHY
Diplôme d’état de sage-femme
LE PLACENTA PRAEVIA
Morbidité néonatale et maternelle
Capacité de dépistage d’un placenta accreta
Etude rétrospective réalisée au CHU d’Angers
Du 1er janvier 2001 au 31 décembre 2010
Mémoire présenté par Louise PAGE
Sous la direction de Mme Vanessa COMBAUD Avril 2012

2

3
ENGAGEMENT DE NON PLAGIAT
Je soussigné(e)………………………….……………………………………………,
déclare être pleinement conscient(e) que le plagiat de documents ou d’une partie
d’un document publiés sur toutes formes de support, y compris l’internet, constitue
une violation des droits d’auteur ainsi qu’une fraude caractérisée. En conséquence,
je m’engage à citer toutes les sources que j’ai utilisées pour écrire ce mémoire.
Signature :
Cet engagement de non plagiat doit être inséré en première page de tous les
rapports, dossiers, mémoires.

4
Je remercie,
le docteur Vanessa COMBAUD, mon maitre de mémoire, pour son aide dans
l’élaboration de ce travail, sa disponibilité et sa bienveillance.
Brigitte GOICHON pour son aide, sa patience, et son aiguillage tout au long de ce
travail.
Laurence SADI pour sa présence quotidienne et sa gentillesse.
L’équipe pédagogique pour la qualité de leur enseignement durant ces quatre années
d’études.
Ma famille, Pierre, mes amis qui m’ont soutenu, de près ou de loin, tout au long de la
réalisation de ce mémoire.

5
INTRODUCTION .......................................................................................................... 9
Première partie : généralités ......................................................................................... 10
I- Le placenta ................................................................................................................ 10
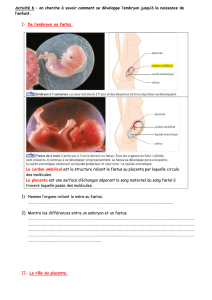
1. La placentation ............................................................................................. 10
2. Rappels anatomiques .................................................................................... 10
2.1. Anatomie macroscopique .................................................................................. 10
2.2. Anatomie microscopique ................................................................................... 11
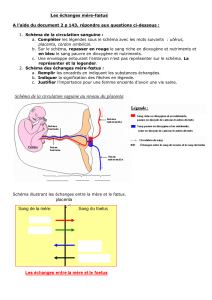
3- Les fonctions du placenta ............................................................................. 11
II Définition du placenta praevia et diagnostic ............................................................. 13
1. définition ....................................................................................................... 13
1.1. Classification anatomique ................................................................................. 13
1.2. Classification échographique ............................................................................. 14
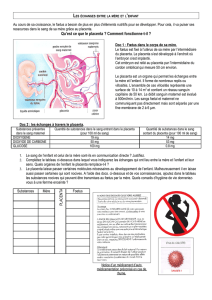
2. facteurs de risques ........................................................................................ 15
3. phénomène de migration placentaire ............................................................ 17
4. diagnostique .................................................................................................. 17
4.1. Clinique ............................................................................................................. 17
4.2. Échographique ................................................................................................... 18
4.3. Anatomopathologique ....................................................................................... 18
III Formes compliquées des placentas praevia ............................................................. 18
1. mécanisme des saignements ......................................................................... 18
2. placenta accreta, increta, percreta, ................................................................ 19
2.1. Définition ........................................................................................................... 19
2.2. Facteurs de risques [17] ..................................................................................... 19
2.3. Diagnostic .......................................................................................................... 20
2.3.1. Signes échographiques : [15] ...................................................................... 20
2.3.2. Signes au doppler couleur et pulsé ............................................................. 20
2.3.3. L’IRM ......................................................................................................... 20
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
1
/
70
100%