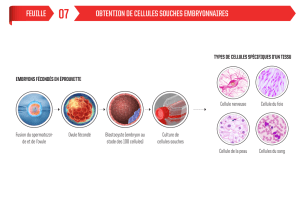
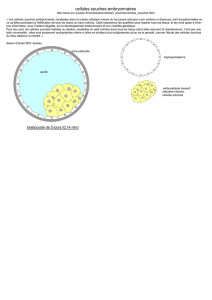
Les cellules souches fœtales et embryonnaires, aux propriétés les

III) Espoir de guérison
A) Thérapie génique :
La thérapie génique est une thérapie qui est actuellement l’un des plus grands espoir de
guérison des maladie génétique. "Pour que la thérapie génique marche, il faut forger toutes
les pièces d'un puzzle et les ajuster parfaitement" Professeur Yves Beuzard (professeur-
chercheur à l’université de Paris Diderot).
Mais qu’est ce que la thérapie génique ?
Les cellules de notre corps se comportent comme de petites usines. Elles fabriquent entre
autres les protéines nécessaires à la bonne marche de notre organisme. Les cellules
fabriquent ainsi des centaines de milliers de protéines différentes grâce aux plans fournis par
notre ADN : les fameux gènes. Quand un gène est défectueux, la protéine qui lui correspond
est donc mal fabriquée et ne joue pas son rôle.
Pour régler ce problème, les chercheurs ont donc pensé fournir aux cellules un plan correct,
sans mutation, c’est-à-dire leur fournir un gène sain, afin que les cellules puissent produire la
protéine qui fait défaut : c’est le principe de la thérapie génique. Si la théorie est simple, en
pratique c’est beaucoup plus compliqué.

Cette méthode consiste à introduire un gène dans les cellules d’un organisme pour corriger
une anomalie à l’origine d’une pathologie. Il s’agit souvent d’apporter un gène normal et
fonctionnel dans une cellule où le gène est altéré.
La thérapie génique suppose de connaitre soit l’anomalie génétique à l’origine de la maladie,
afin d’offrir à la cellule une copie fonctionnelle du gène absent ou défectueux, soit la
fonction du gène qui est inséré. Cette fonction du gène doit pouvoir résoudre le mécanisme
pathologique à l’origine de la maladie. Il convient alors d’isoler le gène-médicament.
Au-delà de la thérapie génique «classique» (transfert de gène-médicament), de nouvelles
techniques sont développées permettant d’intervenir sur le gène lui-même.
En effet, notre ADN ne produit pas directement des protéines. L’ADN permet la fabrication
d’un ARN messager portant les informations qui seront lues pour produire les protéines.
L’ARN contient les informations réellement utiles pour fabriquer les protéines : les exons et
les introns moins utiles. Notre organisme sait parfaitement ne garder que les exons,
information essentielle : c’est ce que l’on appelle l’épissage. L’ARN se débarrasse des parties
non codantes de l’ADN, les introns, et raccorde les parties codantes, les exons.
Les exons seront lus par l’organisme pour fabriquer les
protéines. Quand le brin d’ARN est porteur d’une mutation,
le message décodé n’est pas le bon, la protéine est
modifiée et la personne est malade.
La chirurgie du gène intervient donc au moment de
l’épissage et profite du rassemblement des exons pour «
sauter » les maillons porteurs de la mutation, les exons qui
ne sont pas opérationnels.

L’ARN est alors plus court mais néanmoins lu par la cellule. La protéine produite est alors
plus courte mais elle peut être fonctionnelle. Cette technique est appelée saut d’exon. Les
éléments de biologie moléculaire utilisés pour réaliser cette technique sont appelés
oligonucléotides antisens.
Pour apporter le gène médicament au cœur de la cellule, les chercheurs doivent utiliser un
véhicule particulier : le vecteur.
Les chercheurs se sont posés cette question :
Qu’est-ce qui pénètre facilement dans l’organisme ? Les virus. Les chercheurs se sont donc
inspirés de la nature du virus pour mettre au point des vecteurs capables de pénétrer dans
un grand nombre de cellules et d’y déposer un gène-médicament.
La plupart des vecteurs sont donc issus de virus. Les chercheurs fabriquent les vecteurs à
partir des éléments génétiques de ces virus mais dépourvus de leurs propriétés pathogènes.
Ils introduisent le gène-médicament dans les vecteurs qu’ils souhaitent transférer dans les
cellules du malade.
Une fois fabriqués, les vecteurs sont injectés dans les cellules malades selon différentes
voies d’administration (orale, intra-veineuse, intra-artérielle, intra-musculaire, respiratoire
et réinfusion chez le patient une fois modifiées…). La plupart du temps, les vecteurs sont
confrontés à nos défenses immunitaires qui vont les détruire. Des solutions sont
développées pour contourner les défenses.
L’enveloppe du vecteur doit ensuite être reconnue par la cellule pour pouvoir y pénétrer. La
membrane se creuse et le vecteur se retrouve ainsi à l’intérieur de la cellule, voire dans son
noyau. Le gène-médicament est enfin libéré. La cellule peut alors produire la protéine
absente et la fonction déficiente est rétablie : la cellule est traitée.

Dans les priorités en matière de recherche biomédicale, la recherche pour la mise en
application des biotechnologies, comme la thérapie génique, se place en 3e position, avec
19% des recherches après la recherche sur les causes des maladies (33%) et la recherche
pour la mise au point de nouveaux médicaments ou de nouveaux traitements (29%).

B) Thérapie Cellulaire :
La thérapie cellulaire consiste à greffer des cellules pour réparer ou régénérer un organe ou
un tissu endommagé.
L’être humain est composé de
environ 60.000 milliards de
cellules, qui ont chacune une
fonction précise. Peau, cœur,
foie, cerveau… Il existe environ
230 types de cellules. Certaines
d’entre elles, comme le foie ou
la surface des intestins, sont
capables de reconstituer les
tissus quand ils sont détruits. Ce
n’est cependant pas le cas de
tous les organes. Si nous
perdons trop de sang, qu’une
brûlure est trop importante ou
que l’on est atteint d’une
maladie neuro-dégénérative,
notre corps peine à régénérer
ces cellules et ces tissus.
Pour reconstruire ces organes
et tissus abîmés, les chercheurs
ont donc eu l’idée d’utiliser les
cellules souches, ces cellules de
l’organisme qui sont capables de se reproduire et de renouveler les tissus. La greffe de
moelle osseuse ou la transfusion sanguine peuvent être considérées comme les premières
thérapies cellulaires. Après le traitement de certains cancers ou dans certaines maladies, la
moelle osseuse, qui fabrique les globules rouges, les globules blancs et les plaquettes, ne
fonctionne plus. Pour y remédier, il est possible de greffer des cellules de moelle osseuse
provenant soit du patient, avant le traitement, soit d’un donneur compatible.
L’utilisation des potentialités des cellules souches embryonnaires représente un espoir
majeur pour les maladies rares. Ainsi, en 2009, les équipes d’I-Stem sont parvenues à
reconstruire, à partir de cellules souches embryonnaires, un épiderme puis un épiderme
pigmenté. L’objectif des chercheurs : proposer un jour une ressource illimitée de cellules
pour le traitement de maladies rares de la peau (maladie des enfants de la lune).
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%