notice scientifique

NOTICE SCIENTIFIQUE
DÉNOMINATION
IVEGAM-CMV
(Immunoglobulines humaines anti-CMV)
COMPOSITION
IVEGAM-CMV est préparé à partir du plasma ayant un taux élevé en anticorps anti-
cytomégalovirus; toutes les unités de plasma sont conformes aux prescriptions de la loi du 5
juillet 1994.
Les unités de plasma sont prélevées en Belgique chez des donneurs bénévoles non rémunérés
et sont négatives pour l’antigène de surface du virus de l’hépatite B (HBsAg), pour les
anticorps des virus de l’immunodéficience humaine (HIV-1 et 2 Ac), pour les anticorps du
virus de l’hépatite C (HCVAc).
Outre les mesures habituelles (screening du plasma, précipitation par l’éthanol), la préparation
est traitée par la ß-propiolactone et une filtration, dont les propriétés d’inactivation et
d’élimination virales ont été étudiées, démontrées et documentées. La ß-propiolactone n’est
plus décelable dans le produit fini.
1 ml de solution contient:
- 100 mg de protéines, dont au moins 95% d’immunoglobulines humaines
- 50 I.U. d’anticorps anti-cytomégalovirus
- 155 µmol d’ions Na+
- 155 µmol d’ions Cl-
- Eau pour préparations injectables jusqu’à 1 ml
Formule: Prot. e. sang. hum. ven. 100 mg (Immunoglob. hum. min. 95%) - Immunoglob.
hum. anti-CMV 50 I.U. - Natr. chlorid. 155 µmol - Aqua ad iniect. q.s. ad 1 ml
FORME PHARMACEUTIQUE
Forme: solution injectable
Mode d’administration: perfusion ou injection I.V.
Emballages: - Ampoules de 10 et 20 ml
- Flacons pour perfusion de 50 ml
1
RA-2015/659a/cdm
1

PROPRIÉTÉS
IVEGAM-CMV est préparé à partir de plasma humain, provenant de donneurs sains avec un
titre d’anticorps anti-cytomégalovirus élevé.
Outre les mesures d’usage (analyse systématique du plasma, précipitation à l’éthanol), la
préparation est également traitée par la ß-propiolactone et une filtration, dont les propriétés
d’inactivation et d’élimination virales ont été étudiées, démontrées et documentées. Les
résultats d’études cliniques et d’expériences de documenter les propriétés d’inactivation et
d’élimination des virus. Les résultats d’études cliniques et les données expérimentales
démontrent que l’IVEGAM-CMV n’induit la transmission ni de l’hépatite B, ni de l’hépatite
non-A, ni de l’hépatite non-B, ni de l’infection HIV.
Le produit fini ne contient plus aucune trace de ß-propiolactone.
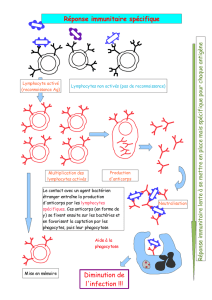
L’administration par voie intraveineuse de l’IVEGAM-CMV offre une protection immédiate
car les anticorps ainsi administrés sont immédiatement disséminés dans la circulation
sanguine. Aucune perte de résorption par dégradation locale n’est constatée; l’effet produit est
immédiat.
INDICATIONS
Prévention des infections à cytomégalovirus (CMV) chez les sujets immunodéprimés et chez
les patients présentant un affaiblissement des défenses immunologiques
(immunosuppression), en particulier après une greffe d’organe.
Traitement adjuvant d’une infection à cytomégalovirus préexistante chez les patients
présentant un affaiblissement des défenses immunologiques, comme les prématurés, les
nouveau-nés, en cas d’immunosuppression d’origine médicamenteuse ou toute autre forme de
déficience immunologique comme le SIDA.
CONTRE-INDICATIONS
Hypersensibilité aux immunoglobulines humaines, comme par exemple dans certaines
déficiences acquises en IgG ou IgA.
EFFETS NON DÉSIRÉS
En cours d'injection ou de perfusion ou suite à celles-ci, l'administration d'IVEGAM-CMV
peut provoquer de la fièvre, des réactions cutanées ou des réactions générales d'intolérance,
pouvant dans de très rares cas aboutir à un état de choc.
Mesures à prendre immédiatement en cas de réaction d’intolérance:
2
RA-2015/659a/cdm
2

Symptômes cliniques Mesures
Troubles subjectifs (dorsalgies, nausées, etc.) Arrêter l’injection/la perfusion
Réactions cutanées (flush, urticaire, etc.) Antihistaminiques
Tachycardie, légère chute de tension
(p. ex. pression systolique de 80-90 mm Hg)
Glucocorticostéroïdes par voie I.V.
(100 à 500 mg de prednisolone)
Dyspnée, état de choc Perfusion continue de dopamine (2-4 µg/kg
de poids corporel/min), administration I.V. de
glucocorticostéroïdes à doses élevées
(jusqu’à 1 g de prednisolone soluble) -
oxygénothérapie, remplissage vasculaire (ex.
solutions colloïdales), éventuellement diurèse
forcée en association avec du furosémide en
cas de normovolémie, contrôle et correction
éventuelle de l’équilibre acide base et des
électrolytes
Etat de choc persistant sans diminution du
volume circulant
Dopamine à la dose maximale de 10 µg/kg de
poids corporel/min, éventuellement associée
à la noradrénaline
Arrêt cardiaque ou respiratoire Réanimation
PRÉCAUTIONS PARTICULIÈRES
Le médecin doit débuter un traitement adéquat lorsque des réactions persistent.
Lors de l’administration de médicaments préparés à partir de sang ou de plasma humain, le
risque d’infection par transmission d’agents infectieux ne peut être totalement exclu. Il en va
de même pour des agents pathogènes d’origine inconnue à ce jour.
Afin de limiter le risque de transmission d’agents infectieux, la sélection des donneurs et des
donations est sévèrement contrôlée. En plus, le processus de production comporte des étapes
spécifiques pour éliminer et/ou inactiver des virus (fractionnement à l’éthanol, traitement par
la β-propiolactone et filtration).
Les étapes actuellement appliquées durant le procédé de production d’IVEGAM-CMV ont pour
effet d’éliminer efficacement les virus possédant une enveloppe lipidique, comme par exemple le
virus de l’immunodéficience humaine, les virus de l’hépatite B et C.
GROSSESSE ET ALLAITEMENT
La sécurité de l’utilisation d’IVEGAM-CMV en cours de grossesse n’a pas été démontrée par
des études cliniques contrôlées.
Une expérience clinique de plusieurs années avec les immunoglobulines montre que ces
substances ne sont pas susceptibles d’avoir des effets nocifs sur le foetus et sur le nouveau-né
lorsqu’elles sont administrées en cours de grossesse.
3
RA-2015/659a/cdm
3

Les immunoglobulines passent dans le lait maternel et peuvent contribuer à la transmission
d’anticorps protecteurs au nouveau-né.
INTERACTIONS
Interactions avec des vaccins contenant des virus vivants atténués:
Lors de 3 premiers mois suivant l'administration d'immunoglobulines, tout vaccin à base de
virus vivants est à déconseiller (rougeole, oreillons ou rubéole) car les anticorps présents dans
IVEGAM-CMV peuvent entraver l'efficacité de ces vaccins.
Les immunoglobulines peuvent également diminuer l’efficacité d’une vaccination qui aurait
été administrée peu de temps (jusqu’à 2 semaines) avant leur perfusion.
Interférence avec des tests sérologiques:
IVEGAM-CMV contient une vaste gamme d'anticorps, qui, après administration, peuvent être
détectés dans le sérum jusqu'à ce qu'ils soient métabolisés par l'organisme. La vitesse de
dégradation dépend de la demi-vie des anticorps. Il en résulte que des analyses sérologiques
trop précoces peuvent donner lieu à des interprétations erronées.
COMMENT L’UTILISER ET EN QUELLE QUANTITÉ
Posologie:
Sauf avis contraire, les instructions posologiques suivantes seront respectées:
Prévention des infections à CMV chez le sujet immunodéficient et chez le patient sous
immunosuppresseurs:
Au minimum 1 ml/kg de poids corporel en une seule prise. Les patients sous immunosuppres-
seurs à la suite d'une greffe d'organe doivent recevoir la première dose le jour même de la
transplantation; en cas de greffe de moelle osseuse, la première dose doit être administrée le
jour précédant l'intervention. Au total, il faut administrer au moins 6 doses unitaires à
3 semaines d'intervalle.
Les autres patients sous immunosuppresseurs doivent recevoir une dose unitaire toutes les 3
semaines. Le nombre de doses unitaires dépendra de l'état des défenses immunologiques ou
de l'intensité de la chimiothérapie.
Traitement d’infections CMV:
Minimum 2 ml/kg poids corporel tous les 2 jours jusqu’à disparition des symptômes
cliniques.
Des résultats positifs peuvent aussi être obtenus avec une dose de 4 ml/kg poids corporel,
administrée aux jours 0,4 et 8, suivi d’une dose de 2ml/kg poids corporel aux jours 12 et 16
(Blacklock H.A. et al, Lancet II (1985) 152-153).
4
RA-2015/659a/cdm
4

Voie d’administration:
IVEGAM-CMV est destiné à la perfusion ou à l’injection intraveineuse.
Si nécessaire, le produit peut être dilué avant perfusion avec du sérum physiologique. En cas
de perfusion, ne pas dépasser le débit de 20 gouttes/minute (soit 1 ml/min).
Avant l’emploi, IVEGAM-CMV doit être amené à température ambiante ou corporelle.
SURDOSAGE
Nous ne disposons à ce jour d’aucune donnée concernant l’apparition et les symptômes d’un
surdosage en IVEGAM-CMV. En cas de réaction d’intolérance, nous vous renvoyons à la
rubrique “Effets non désirés”.
CONDUITE D’UN VÉHICULE ET UTILISATION DE MACHINES
IVEGAM-CMV n’exerce aucune influence sur la conduite d’un véhicule ni sur les capacités à
utiliser des machines.
INCOMPATIBILITÉS
A l’exception du sérum physiologique, IVEGAM-CMV ne peut être mélangé à aucun autre
produit ou médicament, car une modification de la concentration électrolytique ou du pH peut
provoquer une précipitation ou une dénaturation des protéines.
CONSERVATION
IVEGAM-CMV doit être conservé entre +2 °C et +8 °C, dans son emballage d'origine.
N'utiliser que des solutions transparentes.
Les flacons doivent être utilisés immédiatement après leur ouverture sinon la stérilité et
l'absence d'agents pyrogènes ne sont plus garanties.
Durée de validité:
Le produit conservé dans les conditions indiquées peut être utilisé jusqu’à la date de
péremption qui figure sur l’emballage.
La date limite d'utilisation est le premier jour du mois indiqué après la mention Ex. Ex
signifie EXPIRY ou date de péremption, les 2 chiffres qui suivent désignent le mois et les
suivants l’année en date desquels le produit est périmé (mois/année).
5
RA-2015/659a/cdm
5
 6
6
1
/
6
100%