3. Pharmacologie du SRA

1
Pharmacologie du SRA
Introduction
Constituants du SRA
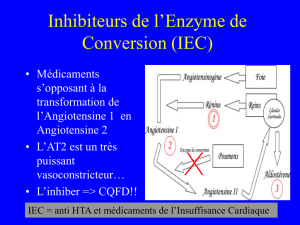
- Angiotensinogène angiotensine I (décapeptide)
angiotensine II (octapeptide) angiotensine III
(heptapeptide)
Rénine (1)
Enzyme de conversion (2)
Aminopeptidase (3)
1) Angiotensinogène
- Fabriquée par le foie
- Structure proche des glycoprotéines
- Synthèse et sécrétion dans un certain nombre de tissus : cerveau, rein, glandes surrénales, vx, cœur)
proportions plus faibles (1 à 5% de la production du foie)
- Production nettement ↗ par
les estrogènes et glucocorticoides ↗ expression de son gène de synthèse.
Autres facteurs : ↗ hormones thyroidiennes, sd inflammatoire, ↗ angiotensine II
- TTT chronique par les IEC entraîne également une ↗ de la libération d’angiotensinogène
2) Rénine
- Enzyme appartenant à la classe des protéases
- Gènes rénine humaine ont été clonés et les séquences aa sont parfaitement définies
- Synthèse de la forme inactive (pro-rénine) commence par la synthèse au niveau des cellules myo-épithéliales de
l’artériole afférente de l’appareil juxta-glomérulaire d’un précurseur de pré-pro-rénine) laquelle pourra
Soit être libérée sous cette forme inactive dans la circulation sanguine
Soit après maturation dans les granules IC, être transformée en rénine qui sera à son tour libérée dans la
circulation.
- La rénine sous sa forme mature active est essentiellement sécrétée au niveau du rein
- La rénine active va agir en tant qu’enzyme protéolytique
Agit spécifiquement sur l’angiotensinogène qu’elle coupe au niveau de la leucine pour la transformer en
angiotensine I.
3) Enzyme de conversion de l’angiotensine I
- Enzyme ubiquitaire chez les mammifères, capable d’hydroxyler les 2 derniers aa de l’extrémité carboxyle de
peptide
- Capable d’hydrolyser en plus de l’angiotensine I et de la bradykinine, de nombreuses autres substances comme
l’enképhaline, substance P et la LH-RH.
Enzyme de conversion membranaire

2
- Des cellules endothéliales (en particulier vx pulmonaires) et des cellules épithéliales
- Dans le cas des cellules endothéliales : le segment EC qui porte 2 sites actifs flotte dans le courant circulatoire.
La concentration est d’autant plus importante que l’organe est richement vascularisé
- Dans le cas des cellules épithéliales, le segment EC se trouve au niveau du pôle luminal de ces cellules
Tubule contourné proximal : peptide filtré
Plexus choroïde : peptides tels que l’enképhaline ou substance P
Lumière intestinale : peptide intestinaux.
Forme testiculaire
Enzyme de conversion circulante
- Ne comporte que les 2 parties extra-membranaires
- Grande diffusion dans l’organisme
- Son taux plasmatique ↗ au cours de certaines pathos (sarcoidose, silicose, hyperthyroidie) ou au cours de
certains TTT.
4) Angiotensines
- Angiotensine I : dépourvu d’activité pharmaco intrinsèque. La perte de ses 2 derniers aa sous action de l’EC
permet formation de angiotensine II (octapeptide actif)
Effets vasculaires de AII
- Puissant VC (40x plus puissante que NA) : touche les artérioles pré-capillaires
- Mécanismes directs : ↗ concentration Ca2+ intra-cytosolique (effet contractile)
- Mécanismes indirects : médiés par système neurovégétatif
- ↗ tonus OS par 3 mécanismes
Stimulation des R pré-synaptiques
Stimulation de la libération des catécho à partir de MS
Action facilitatrice des transmissions ganglionnaires.
- Action sur la trophicité vasculaire : stimulation de la synthèse protéique ainsi qu’une hypertrophie et
hyperplasie cellulaire qui peut expliquer l’épaississement pariétal artériel constaté en physiopath.
Effets cardiaques (AII)
- Effets directs : existence de R spécifique à AII au niveau des myocytes auriculaires et ventriculaires et au niveau
du tissu de conduction
Effets inotropes et chronotropes positifs
Actions trophiques.
Pourrait être à l’origine d’une hypertrophie cardiaque si utilisation comme facteur inducteur des réponses
de croissance du myocarde
- Effets indirects :
Effets inotrope négatif
Par le biais de l’Amélioration de la post charge
Surcharge entraînée par la VC provoque des phénomènes d’étirement stimulation de la synthèse
protéique totale.
Effets rénaux AII
- Effets directs :
Action VC ↘ flux sanguin rénal (s’exerce surtout au niveau efférent : régulation débit rénal et maintien
relatif de la FG en cas de ↘ importante de la PA systémique)
Action directe sur la réabsorption de Na au niveau du TCP par activation de l’échangeur Na+/H+
Effet inhibiteur direct de la sécrétion de rénine.

3
- Effets indirects :
Par le biais de son action sur PA systémique, le tonus OS, la sécrétion d’aldostérone et le SNC.
5) Aldostérone
- Hormone minérolo-corticoide synthétisée au niveau du cortex surrénalien à partir du cholestérol
- Synthèse et sécrétion activées en particulier par AII par le biais d’une action sur des R spécifiques qui par
l’intermédiaire d’une PLC va ↗ le Ca2+ IC
- Autres activateurs de la sécrétion d’aldostérone : kaliémie, ACTH ++, Na, catécho, PG.
Action au niveau du rein : TCD et partie initiale du tube collecteur : réabsorption de Na en échange avec les ions K.
Action cardiaque : production accrue de collagène, hypertrophie myocardique.
I) Pharmacologie des IEC
1) Indications thérapeutiques des IEC
- HTA : pour tous les IEC
- IC (NYHA I à IV) : par dysfonction systolique u VG ↘post-charge + prévention du remodelage.
- IDM : dès les 24 premières heures si situation hémodynamique stable et post-infarctus
- Pour certains IEC : néphropathie débutante en cas HTA et/ou diabète, protéinurie ralentissement de la
progression de l’atteinte rénale.
IEC et néphropathie diabétique
- Stabilisation de IR
- Amélioration de l’hémodynamique rénale (↘ P intra-glomérulaire : source de détérioration de la MB et perte
des néphrons fonctionnels)
- ↘ du débit de protéinurie
- Intérêt particulier dans HTA du diabétique.
2) Pharmacocinétique
- Médicaments bien résorbés : le plus souvent sous forme de pro-médicaments lipophiles)
- Soit directement actifs (ex captopril) soit hydrolyse en métabolites actifs pour la plupart des autres qui sont des
pro-médicaments
- ½ vie : variable 3h pour captotpril, jusque 24H pour lisinopril
- Eliminés par voie rénale : adaptation posologie chez IR
- 1 à 2 prises par jour.
3) Effets indésirables
- Motivant l’arrêt du TTT
Toux sèche : due à l’accumulation de bradykinine et substance P, survenant dans la semaine à 6 mois après
mise en route du TTT
Angio-œdème : accumulation de bradykinine ; au niveau de la face, lèvres, paupières, langue, VAS (œdème
de Quincke pronostic vital), épithélium intestinal = diarrhée, muqueuses génitales +/- urticaire aiguë
↗ de la créatininémie > 30% si hypovolémie efficace avant mise sous TTT (ex diurétiques, régime désodé).
- Autres :
hypoTA : orthostatique ou non (possible dès la 1ière prise si stimulation préalable du SRA)
IRA
hyperK surtout si IR, diabète, prise de K, diurétiques d’épargne potassique
risque accru d’hypoglycémies chez le diabétique sous insuline ou sulfamides
troubles cutanés

4
trouble du goût : dysgeusie, ageusie, neutropénie surtout avec captopril.
4) Interactions médicamenteuses.
- Autres anti-HTA
- Diurétiques si TTT préalable : risque hypoTA, IRA (hémodynamiques systémique et rénales devenues
dépendantes du SRA) mais associations recommandées du fait de sa synergie anti-hypertensive.
- Sels de K et diurétiques d’épargne de K
- Risque de l’association au lithium : adapter la fose de lithium avec renforcement du suivi thérapeutique
(lithiémies)
- AINS : risque majoré d’IR (surtout si patient âgé et/ou déshydraté) : inhibition de la synthèse de PG VD sur
artériole afférente glomérulaire (+ inhibition VC artériole efférente glomérulaire ↘ pression dans les
capillaires glomérulaires)
5) Contre-indications
- Sténose bilatérale des artères rénales ou sur rein fonctionnel unique
- Déplétion hydrosodée marquée
- Angio-œdème sous IEC ou en autre origine (héréditaire par déficit en c1 estérase)
- Grossesse+++ : passage placentaire oligoamnios, RCIU, mort fœtale in utéro, anurie néo-natale
- Allaitement.
II) ARA II
1) Indications
- Surtout HTA :
seuls ou dans le cadre de combinaisons fixes surtout hydrochlorothiazide,
mais aussi amlodipine
parfois tri-thérapies dans une seule présentation avec amlodipine et HCT.
- Spécifique
Losartan, irbésartan : ralentissement de la progression de IR chez diabétiques de type 2 avec protéinurie
Avec cardésartan et valsartan : IC avec dysfonction systolique lorsque les IEC ne peuvent pas être utilisés//
association possible…
2) PC, CI, RI, IM
- PC :
Bonne résorption digestive
Métabolisme hépatique variable d’un sartan à l’autre
Elimination bilio-fécale
- CI : sténose bilatérale des artères rénales et grossesse
- EI : idem IEC mais angio-oedèmes bcp plus rares, pas de toux
- IM : idem IEC dont diurétiques, K, lithium, AINS.
III) Inhibiteur de la rénine
- Aliskiren (resilex ®) : seul inhibiteur de la rénine actuellement utilisé en thérapeutique.
- Action inhibitrice directe et sélective de la rénine
- Biodisponibilité 2/3% diminuée su repas riche en graisse
- ½ vie = 40h : excrétion biliaire (PC PgP dépendante), pas d’ajustement si IR
- Indications : HTA
- EI :
Fréquent= diarrhée parfois sévère

5
Angio-oedèmes
hyperK
autres effets liés au blocage du SRA.
Risque du double blocage du SRA
- Blocage le plus complet proposé comme souhaitable : pour une plus grande efficacité pour s’opposer aux effets
délétères d’une activation excessive de ce système
- Données récentes
Pas de bénéfice par rapport à une monothérapie
Mais surmortalité au moins en dehors de IC
↗ des complications
- Risque plus particulièrement mis en avant avec aliskiren
Arrêt de l’étude ALTITUDE en raison de la survenue d’événements CV et IR chez les diabétiques en
association avec autre bloqueur du SRA d’où une nouvelle indication : PAS D’ALISKIREN AVEC IEC OU ARA II
EN CAS DE DIABETE 1ou 2 OU IR.
Quel bloqueur du SRA privilégier ?
- Pas de données comparatives suffisantes pour aliskiren
- Les données de morbi-mortalité sont plus en faveur des IEC (à privilégier dans HTA)
- Réserver les ARA II si intolérance aux IEC (toux).
1
/
5
100%