les vergetures - Service Central d`Authentification Université de

UNIVERSITE DE NANTES
FACULTE DE PHARMACIE
ANNEE 2006
THESE
pour le
DIPLÔME D’ETAT
DE DOCTEUR EN PHARMACIE
par
MORWENA JEGOU
-------------------------------
Présentée et soutenue publiquement le 29 septembre 2006
Président :
Mme Maryvonne PIRON-FRENET, Maître de Conférences de Toxicologie
Membres du Jury :
Mme Laurence COIFFARD, Professeur de Cosmétologie
Mlle Aline GRELET, Pharmacien
VERGETURES
CAUSES ET TRAITEMENTS

3
TABLE DES MATIERES
REMERCIEMENTS…………………………………………………………………...3
INTRODUCTION............................................................................................................ 7
PARTIE I : LA PEAU ..................................................................................................... 8
I GENERALITES ...................................................................................................................... 8
II L’EPIDERME ......................................................................................................................... 9
II.1 GENERALITES ................................................................................................................................ 9
II.2 LES CELLULES DE L’EPIDERME ...................................................................................................... 9
II.3 LES DIFFERENTES COUCHES DE L’EPIDERME ............................................................................... 10
II.4 LES ROLES DE L’EPIDERME .......................................................................................................... 11
III LE DERME ............................................................................................................................ 13
III.1 LA JONCTION DERMO-EPIDERMIQUE............................................................................................ 13
III.2 STRUCTURE DU DERME ................................................................................................................ 13
III.3 LES CELLULES DU DERME ............................................................................................................ 14
III.4 LA MATRICE EXTRACELLULAIRE ................................................................................................. 15
III.4.1 La substance fondamentale .................................................................................................................... 15
III.4.2 Les composants fibreux .......................................................................................................................... 16
III.4.2.1 Le collagène ..................................................................................................................................... 16
III.4.2.2 Les fibres élastiques .......................................................................................................................... 18
III.5 LES ROLES DU DERME .................................................................................................................. 19
IV L’HYPODERME .................................................................................................................. 19
IV.1 STRUCTURE ET REPARTITION ....................................................................................................... 19
IV.2 ROLES DE L’HYPODERME ............................................................................................................. 21
PARTIE II : LES VERGETURES ...............................................................................22
I DEFINITION ......................................................................................................................... 22
II LOCALISATION .................................................................................................................. 23
III HISTOPATHOLOGIE ......................................................................................................... 24
III.1 L’EPIDERME ................................................................................................................................. 24
III.2 LE DERME .................................................................................................................................... 24
III.2.1 Les fibres de collagène ........................................................................................................................... 25
III.2.2 Les fibres élastiques ............................................................................................................................... 25

4
III.2.3 Les fibroblastes ....................................................................................................................................... 25
III.3 PHENOMENE INFLAMMATOIRE ET MASTOCYTES ......................................................................... 26
IV ETIOLOGIES DES VERGETURES .................................................................................. 27
IV.1 L’OBESITE .................................................................................................................................... 27
IV.2 LA BOULIMIE ET L’ANOREXIE ...................................................................................................... 29
IV.3 LA PUBERTE ................................................................................................................................. 29
IV.4 LA GROSSESSE ............................................................................................................................. 30
IV.4.1 Généralités ............................................................................................................................................. 30
IV.4.2 Diagnostic et localisation des vergetures ............................................................................................... 31
IV.4.3 Origine ................................................................................................................................................... 31
IV.4.4 Facteurs de risques associés à l’apparition des vergetures gravidiques ............................................... 32
IV.4.5 Complications des vergetures gravidiques ............................................................................................. 33
IV.5 CAUSES IATROGENES ................................................................................................................... 34
IV.5.1 Les corticoïdes par voie générale ........................................................................................................... 34
IV.5.2 Les dermocorticoïdes.............................................................................................................................. 35
IV.5.3 L’isoniazide ............................................................................................................................................ 36
IV.5.4 Les contraceptifs oraux .......................................................................................................................... 37
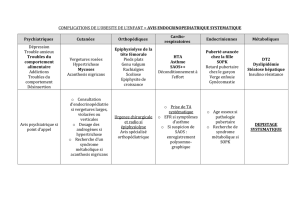
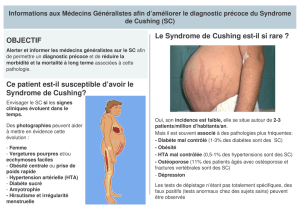
IV.6 LE SYNDROME DE CUSHING ......................................................................................................... 37
IV.7 LE SYNDROME DE MARFAN ......................................................................................................... 38
IV.8 LES TRAITEMENTS DE BLANCHIMENT .......................................................................................... 38
IV.9 CHEZ LE SPORTIF ......................................................................................................................... 39
IV.10 LE RAYONNEMENT SOLAIRE ........................................................................................................ 40
V LES COMPLICATIONS DES VERGETURES .................................................................... 40
PARTIE III : PREVENTION ET TRAITEMENTS..................................................42
I REGLES HYGIENO-DIETETIQUES ................................................................................... 42
I.1 REGLES HYGIENO-DIETETIQUES D’ORDRE GENERAL ................................................................... 42
I.2 REGLES HYGIENO-DIETETIQUES SPECIFIQUES AUX FEMMES ENCEINTES .................................... 42
II COSMETIQUES PROPOSES DANS LA PREVENTION DES VERGETURES ...... 43
II.1 PRICIPAUX CONSTITUANTS DES PRODUITS ANTIVERGETURES .................................................... 43
II.1.1 Les substances lipidiques ....................................................................................................................... 43
II.1.2 Les A.H.A. ............................................................................................................................................... 44
II.1.3 Les plantes .............................................................................................................................................. 45
II.1.3.1 La prêle (Equisetum arvense) et le silicium ....................................................................................... 45
II.1.3.2 Le lierre grimpant (Hedera helix) ..................................................................................................... 46
II.1.3.3 Le millepertuis (Hypericum perforatum) ........................................................................................... 46
II.1.3.4 L’hydrocotyle (Centella asiatica) ...................................................................................................... 47
II.1.3.5 L’alchemille (Alchemilla vulgaris) .................................................................................................... 47

5
II.1.3.6 Le tilleul (Tilia cordata et Tilia platyphyllos) .................................................................................... 48
II.1.4 Vitamines et acides aminés ..................................................................................................................... 48
II.1.4.1 Caroténoïdes et vitamine A ................................................................................................................ 48
II.1.4.2 Vitamine B5 ....................................................................................................................................... 49
II.1.4.3 Vitamine C ......................................................................................................................................... 49
II.1.4.4 Vitamine E ......................................................................................................................................... 49
II.1.4.5 Acides aminés .................................................................................................................................... 50
II.2 EXEMPLES DE PRODUITS COSMETIQUES ANTIVERGETURES ........................................................ 50
III LES MEDICAMENTS PROPOSES DANS LE TRAITEMENT DES VERGETURES 54
III.1 LES RETINOÏDES ........................................................................................................................... 54
III.1.1 Définition et origine ............................................................................................................................... 54
III.1.2 Mécanisme d’action des rétinoïdes ........................................................................................................ 55
III.1.3 La trétinoïne ........................................................................................................................................... 56
III.1.3.1 Généralités......................................................................................................................................... 56
III.1.3.2 Rôles sur la peau ............................................................................................................................... 57
III.1.3.3 Indications ......................................................................................................................................... 57
III.1.3.4 Utilisation de la trétinoïne sur les vergetures .................................................................................... 58
III.1.3.5 Conseils d’utilisation de la trétinoïne................................................................................................. 60
III.1.4 Effets secondaires des rétinoïdes ............................................................................................................ 60
III.1.5 Rétinoïdes et AHA .................................................................................................................................. 61
III.1.6 Conclusion .............................................................................................................................................. 62
III.2 LA N-ACETYLHYDROXYPROLINE ................................................................................................ 62
III.3 L’ACETAZOLAMIDE ..................................................................................................................... 62
III.4 L’EXTRAIT D’HYDROCOTYLE ...................................................................................................... 63
III.5 LES SOUCHES HOMEOPATHIQUES ................................................................................................ 63
IV PRODUITS DE CAMOUFLAGE ....................................................................................... 63
V LES COMPLEMENTS ALIMENTAIRES ............................................................................ 64
V.1 ARKOGELULES HUILE DE BOURRACHE® ..................................................................................... 64
V.2 SILIPHYT’S BOISSON® .................................................................................................................. 64
VI TRAITEMENTS DERMATOLOGIQUES ........................................................................ 65
VI.1 LA MICRODERMABRASION ........................................................................................................... 65
VI.1.1 Définition et principe .............................................................................................................................. 65
VI.1.2 Intérêts de la microdermabrasion .......................................................................................................... 66
VI.1.3 Indications à la microdermabrasion ...................................................................................................... 67
VI.1.4 La première consultation ........................................................................................................................ 68
VI.1.5 Suites opératoires ................................................................................................................................... 69
VI.1.6 Effets indésirables et précautions à prendre .......................................................................................... 70

6
VI.1.7 Histologie et physiopathologie ............................................................................................................... 72
VI.1.8 Contre-indications .................................................................................................................................. 72
VI.2 LES LASERS .................................................................................................................................. 73
VI.2.1 Introduction ............................................................................................................................................ 73
VI.2.2 Principe .................................................................................................................................................. 74
VI.2.3 Lasers abrasifs ....................................................................................................................................... 74
VI.2.3.1 Lasers à CO2 ...................................................................................................................................... 75
VI.2.3.2 Laser Erbium-Yag (grenat d’yttrium et d’aluminium) ....................................................................... 75
VI.2.3.3 Laser Erbium-Yag-CO2 ..................................................................................................................... 76
VI.2.4 Lasers non abrasifs ................................................................................................................................ 76
VI.2.4.1 Lasers à colorant pulsé 585 nm ......................................................................................................... 76
VI.2.4.2 Laser Nd-YAG .................................................................................................................................... 77
VI.2.4.3 Laser UV ............................................................................................................................................ 77
VI.2.5 Contre-indications et précautions d’emploi du laser ............................................................................. 78
VI.2.6 Effets indésirables des lasers .................................................................................................................. 78
VI.2.7 Conclusion .............................................................................................................................................. 78
VI.3 L’IPL (INTENSE PULSED-LIGHT) .................................................................................................. 79
VI.4 LA CHIRURGIE .............................................................................................................................. 81
VI.4.1 Introduction ............................................................................................................................................ 81
VI.4.2 Techniques utilisées ................................................................................................................................ 81
VI.4.3 Précautions à prendre ............................................................................................................................ 84
VI.4.4 Les complications ................................................................................................................................... 85
VI.4.4.1 Complications thrombo-emboliques. ................................................................................................. 85
VI.4.4.2 Hématomes ........................................................................................................................................ 86
VI.4.4.3 Nécrose cutanée ................................................................................................................................. 87
VI.4.4.4 Infection ............................................................................................................................................. 87
VI.4.4.5 Epanchement séro-hématique ou lymphatique .................................................................................. 88
VI.4.4.6 Altérations de la sensibilité pariétale ................................................................................................ 88
VI.4.4.7 Les plaies qui s’ouvrent ..................................................................................................................... 88
VI.4.4.8 Les mauvaises cicatrisations ............................................................................................................. 88
VI.4.5 Aspect financier ...................................................................................................................................... 89
CONCLUSION ..............................................................................................................90
LISTE DES FIGURES……………………………………………………..…………93
LISTE DES TABLEAUX ..............................................................................................93
REFERENCES BIBLIOGRAPHIQUES ....................................................................94
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
1
/
103
100%