IMMUNOLOGIE 4
les voies naturelles de l’infection :
● le tractus respiratoir
● le gastrointestinal
● le urogénital
les couches différents de l’immunité innée:
● barrière anatomique contre l’infection
● les facteurs mécaniques( les épithéliums) : la peau, le mucose
● les facteurs chimiques : un PH faible, lysozyme
● les facteurs biologiques: les défensines, des acides gras
● les composants humorales
● le complément
● des cytokines
● les composants cellulaires
● les cellules myéloïdes
● les lymphocytes NK
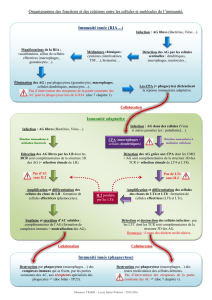
les cellules de l’immunité innée :
_ les lymphocytes NK
Ils sont capables de détecter et de lyser les cellules altérées comme les cellules infectées ou
tumorales . à l’homéostasie , on les retrouve dans le sang et les tissus. La reconnaissance de
leur cible est hautement spécifique bien qu’il soit dépourvu de récepteurs spécifiques des
antigènes comme ceux exprimés à la surface des lymphocytes T et B. les lymphocytes NK
intègre des signaux provenant des récepteurs activateurs et inhibiteurs engagés par leurs
cibles potentielles.
_ les granulocytes
Les éosinophiles , les basophiles , les mastocytes , les neutrophiles dérivées de lignage
myéloïde sont regroupés sous le nom de granulocyte car leur cytoplasme contient de
nombreux vésicules appelés granules. Ces derniers renferment différents médiateurs de la
réponse inflammatoire et allergique. Le contenu de cette granule est spécifique à chaque
sous-type cellulaire. les éosinophiles et les basophiles sont retrouvés dans le sang et des
tissus , les mastocytes sont principalement localisés dans les tissus conjonctifs, les
neutrophiles sont présents dans le sang et ne pénètrent dans le tissu qu’une fois activés.
_ les phagocytes
les neutrophiles , les macrophages et les cellules dendritiques ont la capacité remarquable à
internaliser puis dégrader des cellules ou des particules plus larges que leurs propres
surfaces. Ce mécanisme appelé phagocytose est un moyen de limiter directement la
propagation des pathogènes , d’initier la réponse inflammatoire mais aussi de produire les
antigènes reconnus par les lymphocytes T et B. Les neutrophiles comme des macrophages
sont des phagocytes très efficaces qui jouent un rôle capital dans la mise en place de
l’inflammation et dans l'élimination d’agents infectieux.
La phagocytose des cellules dendritiques n’est pas impliquée dans la clairance directe des
pathogènes ; mais assure la production d’antigènes par ces cellules qui sont indispensables
pour l’activation des lymphocytes T naïves.
_ les monocytes / macrophages
parmi les phagocytes , les macrophages qui sont localisés dans les tissus jouent un rôle de
sentinelle parce qu’ils sont capable de détecter précocement l’intrusion de pathogènes et
d’alerter des autres effecteurs du système immunitaire les macrophages forment un gp
hétérogène des cellules qui sont catégorisés sur la base de leurs localisations et de leurs
phénotypes. Ils incluent les macrophages alvéolés présents dans les poumons, les cellules

de kupffer dans le foie , la microglie dans le cerveau et les histiocytes localisés dans les tissus
conjonctifs interstitiels . ces macrophages acquièrent différents caractéristiques en fonction
des stimulis perçues et assurent des fonctions pro ou anti inflammatoires; ainsi lors qu’ils sont
stimulés par de IFN-gamma , ils sont efficace dans la lutte contre des pathogènes ou la
destruction des cellules tumorales . En revanche , lorsqu'ils sont stimulés par IL-4 , ils
acquièrent des fonctions régulatrices et sont impliqués dans la réparation tissulaire ou la
résolution de l’inflammation.
les phases de la phagocytose
La phagocytose est une cascade d'événements parfaitement orchestrés qui commence dès
l’interaction du pathogène ou de la particule avec le phagocyte.cette interaction peut être
directe par la reconnaissance de motifs spécifiques du pathogène ou indirecte par
l'intermédiaire d’opsonines qui sont molécules de l'hôte qui vont recouvrir ce pathogène.
Après l'attachement, le phagocyte va englober la particule en formant des extrusions
membranaires appelées pseudopodes . Suite à cette internalisation, le microorganisme est
piégé dans une vésicule , le phagosome , qui dérive de la membrane plasmique. cette
environnement tout d’abord inoffensif , va acquérir des fonctions microbicides au cours d’un
processus de maturation.cette conversion dans le macrophage se fait au cours d’événement
de fusion avec le compartiment de la voie endocytique qui vont aboutir à la formation du
phagolysosome après fusion avec les lysosomes. dans le neutrophile, la maturation du
phagosome a lieu lors de la fusion avec les granules qui sont contenus dans son cytoplasme.
digestion des microbes ingérés par des enzymes , formation de corps résiduels contenant des
matières non digestibles, rejet des déchets.
récepteurs impliqués dans la phagocytose:
Les phagocytes sont capables d’identifier la nature des particules ingérées grâce à
l’expression de tout un panel de récepteurs qui vont déclencher le processus d’internalisation
et activer des voies de signalisation conduisant à des réponses adaptées . La voie la mieux
décrite est celle impliquant les récepteurs qui reconnaissent la partie FC des
immunoglobulines. Les IGGs sont des opsonines qui vont interagir avec les microorganismes
via leur partie variable et se lier aux récepteurs FC présents à la surface des phagocytes via
leur partie constante. Les phagocytes possèdent également des récepteurs au facteur du
complément qui opsonisent les bactéries en interagissant avec des glycoprotéines spécifiques
de ces pathogènes. Ils sont aussi capables d’interagir avec leurs cibles par l'intermédiaire de
récepteur scavenger qui se lie à des motifs microbiens plus ou moins bien définis. Les
phagocytes peuvent aussi reconnaître et éliminer les corps apoptotiques notamment via
l'intégrine alfaVbeta5. enfin les phagocytes expriment des récepteurs PRRs qui reconnaissent
différents motifs moléculaires présents sur les agents infectieux , les PAMPs. l’engagement de
telles récepteurs comme les TLRs va favoriser leur phagocytose et déclencher la sécrétion de
cytokines pro inflammatoires telles que IL-1,IL-6 ou TLF.
l’activité microbicide des phagocytes :
Après l’internalisation du pathogène,le phagosome formé va subir différentes étapes de
maturation pour acquérir tout un arsenal de molécules toxiques. Sous l’action d’une ATPase,
la lumière de phagocyte va s’acidifier pour atteindre un PH de 4-5. Cette acidification va
altérer la croissance de la bactérie en agissant directement sur son métabolisme mais va
permettre également l’activation d’enzymes hydrolytiques qui fonctionnent à faible PH tel que
le lysozyme. La phagocytose des particules va déclencher par ailleurs la formation de
radicaux libres azotés et oxygénés lors du processus appelé burst oxydatif qui correspond à

une brusque consommation d'oxygène. l’activation de la NADPH oxydase est la clé de ce
burst puisqu’elle va catalyser la transformation initiale de l’oxygène en anion superoxyde.
Les dérivées réactives de l’azote sont produites suite à l’activation NO synthase inductible
(iNOS), particulièrement étudiés dans les macrophages. Ces radicaux libres sont bactéricides
mais peuvent également agir comme des molécules de signalisation.
l’internalisation de particules provoque par ailleurs la production de protéines et peptides
antimicrobiens. Ils peuvent agir directement sur la croissance ou altérer l'intégrité du
microorganisme. La Lactoferrin par exemple, va limiter l’apport nutritionnel dans le
phagosome en bloquant l’apport en fer.
Les défensines quant à elles, vont se fixer à la surface des bactéries et induire la
perméabilisation de leurs membranes.
résistance des microorganismes à la destruction des phagocytes
Certains pathogènes ont développé différentes stratégies d’échappement qui ciblent 1 ou
plusieurs de ces mécanismes antimicrobiens et leur permettent de survivre après
phagocytose. En plus de pouvoir interférer avec leur internalisation, ils sont capables de
modifier leurs surfaces pour résister aux peptides antimicrobiens ou encore d’exprimer
certaines enzymes comme la catalase qui convertit des dérivés réactifs d’oxygènes en
composés moins toxiques. Il peut enfin bloquer la mise en place des complexes protéiques à
l’origine de ces dérivés réactifs.
les macrophages font la différence entre les bactéries mortes et vivantes :
différents données expérimentales laissent suggérer que la phagocytose jouent un rôle
clé dans l’identification de la nature du micro organisme infectant l'hôte et permettent
d’induire une réponse appropriée au type de menace à laquelle il est exposé par
exemple le macrophage sans pouvoir différencier les bactéries mortes des bactéries
vivantes. Dans l’étude qui est rapporté ce phénomène , il est montré que
l’internalisation de E.coli morte ou vivante, induit la production et la sécrétion d' IL-6.
En revanche, seules les bactéries vivantes sont capables d’induire la sécrétion
d’IL-1beta mature capitale dans l’inflammation.
l’ARN bactérien libéré uniquement lors de la destruction des bactéries vivantes et non
des bactéries mortes dans lesquelles il a été dégradé ; semble etre à la base de cette
discrimination. l’ARN bactérien activerait des récepteurs cytosoliques impliqués dans
la maturation d’IL-1beta.
les granules des neutrophiles :
Les granulocytes sont caractérisés par la présence de nombreux vésicules dans leur
cytoplasme “les granules” qui contiennent différents médiateurs de la réponse
inflammatoire et allergique. Les granules des neutrophiles sont particulièrement bien décrits
et sont classés en fonction de leur contenu et de leur capacité à être mobilisés .
● Les granules primaires , regorgent de composés antimicrobiens tels que
les défensines , le lysozyme , ils contiennent également de la
myéloperoxydase impliqué dans la génération de dérivés actifs de
l’oxygène et de l'Élastase ; une protéase neutre.
● les granules secondaires , sont caractérisés par la présence de la
Lactoferrin et l’absence de la myéloperoxydase.
● les granules tertiaires , contiennent moins de produits antimicrobiens et
servent de vacuole de stockage pour la gélatinase; une métalloprotéase.
Ces éléments sont autant d’agents microbicides , indispensables au contrôle de la
prolifération du pathogène.
La dégranulation et la phagocytose ont non seulement une action microbicide mais sont
également la source de signaux d'alerte de nature variée. Parmi ces signaux, on retrouve

des cytokines et des chimiokines inflammatoires, des médiateurs lipidiques de
l’inflammation ou encore de l’histamine contenue principalement dans les granules de
mastocytes.
la dégranulation des neutrophiles :
l’ingestion d’un pathogène par le neutrophile va déclencher l’expulsion du contenu de ces
granules selon la processus de dégranulation. Le contenu des vésicules peut être relargué
dans le milieu extérieur ou dans le phagosome contenant le pathogène. Les granules
secondaires sont plus prônes à fusionner avec la membrane plasmique pour décharger leur
contenu à l’extérieur de la cellule. Les granules primaires déversent leur contenu
majoritairement dans le phagosome pour former le phagolysosome. Cela permet à la fois
d’éliminer les pathogènes ingérés et les pathogènes extracellulaires.
la dégranulation des mastocytes :
Tous les granulocytes sont capables de dégranuler mais la nature du stimulus déclenchant
cet événement est différente selon le type cellulaire. les mastocytes expriment à leur surface
des récepteurs aux fragments FcϵRI des immunoglobulins E qui sont prêts à associer à ces
IgE.de ce fait, lorsqu’une molécule multivalente est reconnue par la partie variable de l’IgE ,
cela induit un crosslinking de leurs récepteurs qui fournit le signal déclenchant la
dégranulation. Les granules de mastocytes sont riches en histamine , responsable
notamment des symptômes associées à l'allergie.
NET:
La libération du contenu des granules peut induire d’autres mécanismes antimicrobiens
comme le déploiement du piège extracellulaire des neutrophiles (NET). ces NETs sont
des réseaux de fibres extracellulaires(constitués d’ADN et d’histone) produits par le
neutrophile en réponse à la reconnaissance d’un pathogène.
Les mastocytes et les éosinophiles semblent également pouvoir relarguer de tels pièges.
les différents étapes conduisant à la libération de NET:
1. l’engagement des récepteurs à la surface des neutrophiles
2. le contenu des granules va être relargué
3. la myéloperoxydase et l'élastase sont des acteurs majeurs de la
formation des NETs; puisque leur déficience a été associée à l’absence
de NET. Les Histones sont ensuite dégradées et les membranes
intracellulaires désagrégées.
4. Enfin, la membrane plasmique est rompue et le matériel cytoplasmique
et nucléoplasmique est expulsé en dehors de la cellule sous forme de
NET qui va piéger les pathogènes extracellulaires.
IN BRIEF : les effecteurs myéloïdes du système immunitaire innée utilisent des
mécanismes communs tels que la phagocytose, la dégranulation et la formation des
NETs .
__________________________________________________________________________
Si les cellules myéloïdes partagent de nombreuses fonctions, elles restent cependant
complémentaires et ne peuvent se substituer les unes aux autres. Leur spécificité
réside dans leur localisation cellulaire, leur durée de vie, ainsi que leur activité
microbicide et immunomodulatrice. une réponse immunitaire innée efficace repose
sur l’interaction de ces différents partenaires. les macrophages et les mastocytes
résidants dans les tissus, agissent comme des sentinelles; lorsqu’un tissu est infecté,
ils sont parmi les premiers à détecter les pathogènes et à lancer l'alerte en produisant
des médiateurs de l’inflammation.
à travers la production des chimiokines et des facteurs augmantant la pérméabilité
vasculaire, ils vont recruter majoritairement des neutrophiles qui représents chez
l’homme prés de 70% des globules blanc du sang. leur durée de vie contrairement aux
macrophages est relativement courte ce qui permet probablement un contrôle de leur

activité cytotoxique potentiellement délétère pour l'hôte. Cependant cette durée de vie
augmente de façon importante durant l’inflammation , ce qui lui permettrait d’assurer
des fonctions plus complexes. Dans le tissu,les neutrophiles vont pouvoir participer à
l’élimination des agents infectieux par des mécanismes comme la phagocytose, la
dégranulation et la formations des NETs.
Ils vont également participer à une seconde vague de recrutement en produisant à
leur tour des chimiokines et médiateurs de l’inflammation. les monocytes; cellules
myéloïdes circulants dans le sang,vont également être mobilisés dans les tissus
lésés, ou ils vont se différencier en macrophages pro inflammatoire et amplifier la
réponse initiale.
une fois l’infection contrôlée, la phase de résolution est initiée.là encore, les
effecteurs innées vont interagir en jouant des rôles complémentaires. bien que les
macrophages soient décrits comme majeurs dans ce processus à travers l'acquisition
d’un phénotype anti inflammatoire de type M2,les neutrophiles contribuerait aussi à
cette phase en modulant leur production de prostaglandins et de leucotriènes; par
ailleurs, l’ingestion de neutrophiles apoptotiques par les macrophages induirait la
production des molécules tels que les résolvines requises pour stopper le
recrutement de nouveaux effecteurs.
1
/
5
100%