Chimie PCSI
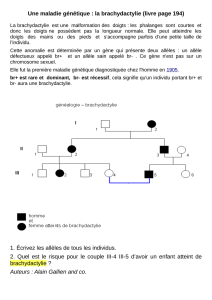
_______________________________________________________________________________
DEVOIR SURVEILLE DE CHIMIE N°5 - PCSI
Durée : 2 heures
Usage de la calculatrice : autorisé
Consignes :
Une grande attention doit être accordée à la qualité de la rédaction, à la présentation et au soin de
la copie
Il est demandé de toujours travailler avec des expressions littérales, en respectant les
notations dans les énoncés, et de ne passer aux applications numériques qu’une fois les résultats
littéraux obtenus. Les résultats des applications numériques doivent être écrits avec un nombre de
chiffres significatifs adapté
Si un étudiant repère ce qui lui semble être une erreur d’énoncé, d’une part, il le signale au
surveillant, d’autre part, il le signale sur sa copie et poursuit sa composition en indiquant les raisons
des initiatives qu’il est amené à prendre.
Exercice 1 – Une nouvelle génération de batteries
Alors que les sources d’énergies intermittentes (comme les panneaux solaires ou les éoliennes) prennent une
part de plus en plus importante, il est devenu capital de stocker une grande quantité d’énergie. Les batteries
solides ont un temps de décharge bien trop court pour être utilisées avec ce genre de source d’énergie. La
solution est alors d’utiliser un accumulateur à flux liquide, où l’espèce électroactive circule entre un réservoir
et la demi-cellule électrochimique où a lieu la réaction électrochimique. Un de ces accumulateurs prometteurs
est la batterie brome/anthraquinone dont le schéma de fonctionnement est donné ci-dessous.
Données :
• Réservoir brome : E° (Br2/Br−) = 1,087 v
• Réservoir anthraquinone : E°(A/AH2) = 0, 21 V où A représente l’acide anthraquinone -2,7-
disulfonique et AH2 l’acide -9,10- dihydroxyanthracène -2,7- disulfonique dont les formules topologiques sont
données ci-dessous :
___________________________________________________________________________________________________________
Lycée naval 2018 - 2019 Page 1 / 6

1- Etude des espèces chimiques présentes dans chaque réservoir de l’accumulateur
1.1- Le premier réservoir de l’accumulateur fait intervenir le couple A/AH2.
Ecrire la demi-équation associée au couple A/AH2 en utilisant les formules topologiques fournies.
Identifier l’espèce chimique jouant le rôle d’oxydant et celle jouant le rôle de réducteur.
1.2- Les fonctions -SO3H présentes dans l’espèce chimique A sont des acides forts dans l’eau : donner la
définition d’un acide fort. Ecrire l’équation de la réaction d’échange protonique entre le diacide fort A et l’eau
(en utilisant les formules topologiques pour A et sa base conjuguée).
1.3- Le deuxième réservoir de l’accumulateur est un mélange de dibrome Br2 et de son réducteur conjugué,
l’ion bromure Br-. Le dibrome est peu soluble en solution aqueuse. Afin d’augmenter la solubilité du dibrome,
on opère avec un excès d’ions bromure : on observe alors la formation d’ions tribromure Br3-, selon l’équilibre
chimique :
Br2(aq) + Br-(aq) = Br3-(aq) de constante d’équilibre K° = 16,8
1.3.1- Donner la configuration électronique de l’élément brome (Z = 35) dans son état fondamental. En
déduire sa position dans la classification périodique des éléments et les nombres d’oxydation extrêmes
accessibles pour l’élément brome.
1.3.2- Ecrire la demi-équation d’échange électronique associée au couple Br2/Br-.
Donner l’expression littérale du potentiel de Nernst associé à ce couple.
1.3.3- Ecrire la demi-équation d’échange électronique associée au couple Br3-/Br-.
Donner l’expression littérale du potentiel de Nernst associé à ce couple.
1.3.4- Sachant qu’il y a unicité du potentiel d’électrode à l’équilibre, exprimer la différence de potentiels
standards E°(Br2/Br-) - E°(Br3-/Br-) en fonction de la constante d’équilibre K° donnée plus haut.
Calculer E°(Br2/Br-) - E°(Br3-/Br-) et conclure : la formation de l’ion Br3- rend-elle le dibrome plus ou moins
oxydant ?
2- Fonctionnement de l’accumulateur
On note S l’état de la charge de l’accumulateur, exprimé en pourcentage. Lorsque S vaut 0, la batterie est
totalement déchargée et lorsque S vaut 100 %, la batterie est totalement chargée.
Le compartiment 1 est initialement rempli d’une solution neutre contenant les espèces chimiques A et AH2
(étudiées dans la première partie), toutes deux à la concentration 1,0 mol.L-1 et le compartiment 2 est rempli
d’un mélange d’ions bromure Br- à la concentration 3,0 mol.L-1 et du dibrome à la concentration 0,50 mol.L-1.
On rappelle que les deux couples d’oxydoréduction intervenant dans l’accumulateur sont A/AH2 et Br2/Br-.
2.1- En tenant compte de la formation de l’ion tribromure Br3-, déterminer la concentration en ions bromures
Br- et en dibrome Br2 à l’équilibre.
En déduire la valeur du potentiel E(Br2/Br-) dans le compartiment 2.
2.2- Déterminer la valeur du potentiel E(A/AH2) dans le compartiment 1, en considérant que la solution est
neutre.
2.3- Déduire des deux questions précédentes la valeur de la fém de la pile constituée par association des
compartiments 1 et 2.
2.4- Déterminer la nature anodique ou cathodique des compartiments 1 et 2 lors de la décharge de
l’accumulateur.
Ecrire l’équation de réaction associée au fonctionnement de l’accumulateur.
___________________________________________________________________________________________________________
Lycée naval 2018 - 2019 Page 2 / 6

Exercice 2 – L’aspartame et l’acide aspartique
L’aspartame est un édulcorant artificiel découvert en 1965. C’est un dipeptide composés de deux
acides aminés naturels, l’acide aspartique et la phénylalanine.
Acide aspartique Aspartame Phénylalanine
1- Donner la formule brute de l’aspartame.
2- Recopier la formule topologique de l’aspartame. Entourer et nommer les fonctions organiques
présentes dans cette molécule.
3- Justifier le nom d’ « acide aminé » donné aux molécules d’acide aspartique et de phénylalanine.
4- L’aspartame est un acide au sens de Brönsted : rappeler la définition d’un acide au sens de
Brönsted.
5- On définit aussi la notion d’acide au sens de Lewis : l’aspartame est-il un acide au sens de
Lewis ? Justifier la réponse.
Du fait de la présence de deux groupes carboxyles et d’un groupe amino, l’acide aspartique peut
exister sous quatre formes acido-basiques notées H3A+, H2A, HA- et A2-. Trois constantes d’acidité
sont donc associées à l’acide aspartique ; elles sont notées : Ka1, Ka2 et Ka3 (numérotées par force
décroissante de l’acide du couple). On définit les pKa correspondants : pKa1 pour le couple
H3A+ / H2A, pKa2 pour le couple H2A / HA- et pKa3 pour le couple HA- / A2-.
Pour déterminer les valeurs numériques de ces constantes d’acidité Ka1, Ka2 et Ka3, on réalise le
titrage d’une solution d’acide aspartique sous sa forme la plus acide notée H3A+ par la soude
(Na+(aq) ; HO-(aq)).
6- Ecrire les équations des réactions associées aux constantes d’équilibre Ka1, Ka2 et Ka3.
7- Lors du titrage d’un volume VA = 10,0 mL d’une solution aqueuse d’acide aspartique de
concentration CA par la soude de concentration CB = 0,10 mol.L-1, on obtient les courbes données en
page 4.
___________________________________________________________________________________________________________
Lycée naval 2018 - 2019 Page 3 / 6

Sur cette courbe de titrage, on a superposé le diagramme de distribution des différentes espèces
H3A+, H2A, HA- et A2-.
Attribuer, en justifiant, les courbes de distribution à chacune des quatre espèces précédentes.
8- En utilisant les courbes de distribution, déterminer les valeurs des 3 pKA associés à l’acide
aspartique. Justifier la réponse.
En déduire les valeurs des trois constantes d’acidité Ka1, Ka2 et Ka3.
9- Entre V = 0 et 20,0 mL, la réaction de titrage qui a lieu a pour équation :
H3A+ + 2 HO- HA- + 2H2O de constante d’équilibre K°
9.1- Justifier que les dosages de H3A+ et H2A soient simultanés.
9.2- Exprimer la constante d’équilibre K° (associée à la réaction de titrage pour V compris entre 0 et
20 mL) en fonction de Ka1, Ka2 et Ke.
Calculer K° et commenter.
9.3- Déterminer la concentration de l’acide titré.
10- L’amplitude du deuxième saut de pH est très faible. Proposer une autre technique qui
permettrait de mieux repérer cette deuxième équivalence.
___________________________________________________________________________________________________________
Lycée naval 2018 - 2019 Page 4 / 6

Exercice 3 – Le complexe « bleu céleste »
En présence d’ammoniac NH3 en quantité suffisante, les ions cuivriques Cu2+(aq) donnent un
complexe d’un très beau bleu, [Cu(NH3)4]2+, selon l’équation :
Cu2+(aq) + 4 NH3(aq) = [Cu(NH3)4]2+(aq) de constante d’équilibre K = 1012,3
On place dans un becher 90 mL d’une solution aqueuse d’ions cuivriques à 1,0 10-3 mol.L-1.
A l’instant initial, on y ajoute 10 mL d’une solution ammoniacale NH3 à 5,0 mol.L-1 .
Donnée : pKA(NH4+/NH3) = 9,2
1- Déterminer le pH initial de la solution obtenue, juste après mélange des deux solutions.
2- A l’aide d’un bilan de matière, déterminer la concentration en complexe [Cu(NH3)4]2+ à l’équilibre.
3- Déterminer la concentration en ions cuivriques Cu2+ à l’équilibre.
Conclure : existe-t-il des ions cuivriques « libres » (c’est-à-dire non complexés) en présence du
ligand NH3 ?
Justifier alors l’utilisation de ce complexe pour la détection de traces d’ions cuivriques en solution
aqueuse.
Attention ! Exercice 4 à traiter en page 6
___________________________________________________________________________________________________________
Lycée naval 2018 - 2019 Page 5 / 6
 6
6
1
/
6
100%