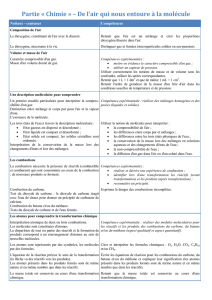
Réponds aux questions de l`animation appelée « les équations bilan

B. Les combustions explosives : à l’intérieur d’un moteur, on cherche à faire exploser un mélange air-essence (ou
air/gasoil). D’autre part, certaines maisons peuvent exploser à la suite d’une fuite de gaz, mais cela ne se produit pas
toujours : cela dépend de la quantité de combustible et des proportions comburant/combustible
Les combustions peuvent être explosives lorsque le combustible et le comburant sont mélangés dans des proportions
bien précises.
Toute utilisation de gaz combustible doit donc être faite avec une installation conforme aux normes de sécurité. Si on
détecte par l’odeur une fuite de gaz dans une maison, fermer la bouteille, aérer la pièce, sortir, ne pas allumer de
lumière électriques qui provoquerait une étincelle et appeler les secours selon la situation.
C. Pourquoi certaines voitures produisent-elles une grosse fumée noires?
L'essence est un mélange d'hydrocarbure, les gaz d'échappement ne devraient donc contenir que
.............................................................. et ............................................... qui sont des gaz ………………….
Pourtant, lorsque le moteur est froid ou mal réglé, la combustion ne se passe pas comme prévue : on dit qu’elle est
incomplète.
Essayons de "gêner" la flamme d'un briquet à l'aide d'une soucoupe retournée : il se forme de la fumée noire et des
particules noires de carbone se déposent sur la soucoupe
PAR : La fumée est constitué de particules de carbones fines, mais solides, entrainée par les produits de combustions
gazeux et chaud. Ce n’est pas un gaz. Elle est produite lorsque la combustion est incomplète
D. Les dangers des combustions incomplètes. Lors d’une combustion incomplète, il se forme, en plus de la fumée (du
carbone), du monoxyde de carbone, qui est un gaz très dangereux pouvant provoquer la mort par intoxication et
asphyxie Appareil à combustion mal réglé + aération bouchée et/ou petit volume
= danger de mort par intoxication au monoxyde de carbone
Copier la PAR3p49 + PAR 4p49 + carte d’identité du monoxyde de carbone p 47
A/Peut-on expliquer ce qui se passe dans un briquet avec le modèle moléculaire ?
4- Il se forme du ………………….
Et de ……………………………..
3- Le butane réagit avec le ………………… de l’air : ces deux corps semblent
disparaître
2- Le butane à l’état …………….. sort du réservoir à cause de la
………………
1- Le butane passe de l’état …………
à l’état ………………………………
dès qu’il y a de la place. Il s’agit d’un ………………………………………
Le modèle moléculaire permet de l’expliquer facilement.
B/ Peut-on expliquer ce qui se passe dans la flamme avec le modèle moléculaire ?
BUTANE (gaz) + DIOXYGÈNE (gaz) DIOXYDE DE CARBONE (gaz) + EAU (gaz)
Il n’est pas possible de comprendre simplement ce qui se passe : cela ressemble pour l’instant à un “tour de magie” : il y a
nécessité d’un nouveau modèle qui doit garder les avantages du modèle moléculaire simple (permettant d’expliquer les
changement d’états), tout en étant capable d’expliquer la disparition des réactifs et l’apparition de nouveaux produits,
c’est à dire en fait la TRANSFORMATION DES PRODUITS EN REACTIFS.
John dalton (voir p12) a découvert au 19ème siècle que les molécules sont elles même constituées de particules “attachées”
entres elles, appelées atomes
PAR : Les molécules sont constituées d’……………..…comme les mots sont constitués de lettres. Il
n’existe que 26 lettres dans l’alphabet. De même l’”alphabet” de l’univers est composé d’une centaine
d’…………………… qui peuvent formé une infinité de …………………..…………
+
+

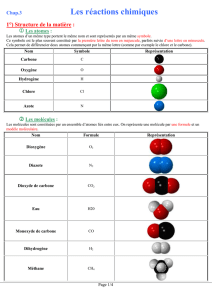
C. Le nouveau modèle moléculaire Animation « formule chimique »
Compléter ce tableau à l’aide de l’onglet « voir » en haut à gauche de l’animation
Modèle de l’atome
(rouge)
Nom de l’atome
Symbole de l’atome
Cherche ensuite à l’aide de l’animation, comment le modèle d’une molécule permet de trouver sa formule et
réciproquement. Complète le tableau :
Modèle de la
molécule
Nom
Formule
Nom et
nombre des
atomes qui
constituent
cette molécule
Ex :
- 2 atomes
d’oxygène
A ton avis, que signifie le préfixe « di » que l’on trouve dans dioxygène et dioxyde de carbone ?
……………………………………………………………………………………………………………………
Seconde animation : Exercice-Quizz « atome et molécules »
Dans la molécule H2O, le « 2 » signifie qu’il y a deux atomes
d’hydrogène ?
VRAI
FAUX
Comment s’appelle la molécule formée d’un atome de carbone et
de deux atomes d’oxygène ?
……………………………………………….
Dans la molécule CH4, le « 4 » signifie qu’il y a quatre atomes en
tout, donc 1 de carbone et trois d’hydrogène ?
VRAI
FAUX
La formule de la molécule de glucose est C6H12O6, elle est donc
composée de
- ………… atomes de ………………..
- …………..atomes de ………………..
- …………. atomes de ………………
Dans une molécule d’éthanol de formule C2H6O, il y a ………………. atomes (en tout)
Dessiner la molécule d’éthane, de formule C2H6
Copier la PAR 1p64
A. Comment le nouveau modèle moléculaire permet-il d'expliquer les combustions :
Réponds aux questions de l’animation appelée « les équations bilan : introduction »
Quelle phrase illustre le mieux le raisonnement utilisé dans cet exercice ? Cocher la ou les bonnes réponses
Rien ne se perd : tout ce que j’ai au départ doit se retrouver à la fin
Rien ne se crée : tout ce que j’ai à la fin devait exister au départ
Tout se transforme : ce qu’on a au départ permet de former ce que l’on a à l’arrivée
Ce célèbre principe « Rien ne se perd, rien ne se crée, tout se transforme » est du à Lavoisier, chimiste français du 18ème
siècle considéré comme le père de la chimie moderne.
Améliore cette phrase en complétant les pointillés avec les mots « atomes » et/ou « molécules »
PAR : Aucun(e) ………………..…….. ne se perd, aucun(e) ………………….………. ne se crée, tous(tes) les
……………………. se transforment. Les …………………..…. des réactifs se cassent et les
……………………. libérés se réarrangent pour former les ………………………….………….. des produits. Il
y a disparition des ………………………… des réactifs, formation des ………………………. des produits,
mais conservation des ……………………….. au cours d’une réaction chimique. Une équation-bilan doit donc
être équilibrée en ajustant le nombre de chaque …………………….., mais sans modifier les formules
chimiques des réactifs et des produits (c’est à dire sans changer le nombre d’…………………. présent dans
chaque …………………….

Animation : équilibrer une équation bilan : compléter le tableau à l’aide de l’animation ou des PAR 2et 3 p64-65
Combustion du carbone
modèle
● + ●● ●●●
bilan
équation bilan
Combustion du méthane
modèle
bilan
équation bilan
Voir fiche méthode 1p208 du livre pour apprendre à équilibrer l’équation-bilan de la combustion du méthane
PAR : Un bilan permet de décrire une réaction chimique avec les noms des réactifs et des produits. La flèche se lit
« donne ». Les réactifs sont à gauche de la flèche. Les produits sont à droite de la flèche.
Une équation-bilan permet de décrire une réaction chimique avec les formules des réactifs et des produits.
+ copier la PAR 3p65à la suite et encadrer le tout.
B. Que devient 1kg de charbon de bois brulés dans un barbecue? David a lu sur internet qu’1kg de carbone brulé libérait
dans l’atmosphère 3.6 kg de dioxyde de carbone. Il pense que ça n’est pas possible, car selon lui, le gaz formé est
forcément plus « léger » que le charbon de bois brulé.
1. Lis l’activité 4p63 qui montre une autre réaction chimique que la combustion du carbone. fait un schéma annoté de cette
expérience (fig1,2 et3), et donne un titre à ce schéma : « Réaction chimique entre la craie et un acide »
2. La masse de la craie a-t-elle diminué ? Les « molécules » de craie ont-elles «disparu » ?
3. Les atomes qui constituaient ces molécules sont-ils encore dans le flacon ? justifie.
4. S’ils n’ont pas disparu, que sont-ils devenus ?
5. A quoi est égale la masse des produits formés par une réaction ? exactement la masse des réactifs « disparus » ? un peu
moins ? un peu plus ?
6. Ce que David a lu est-il possible ? justifie. Quelle masse de dioxygène réagit avec 1kg de carbone ?
7. La masse de 1L de CO2 est de 1.8g. Quel est le volume occupé par 3.6 kg de CO2 ?
Copie la PAR 4p65 et encadre-la en rouge
C. Quelles différences y a-t-il entre une combustion, une réaction chimique, une séparation, un mélange, une dissolution et
un changement d’état ?
Changement d’état : lorsque que le glaçon fond, l'eau reste de l'eau : elle passe simplement de l’état solide à l’état liquide.
On peut assez facilement revenir en arrière en modifiant la température et/ou la pression.
Mélange : réunion de deux corps chimiques qui conservent leur nature. On peut assez revenir en arrière en utilisant
certaines techniques (décantation, filtration, distillation, chromatographie, etc) : c’est une séparation de mélange
Dissolution : lors de la dissolution du sucre dans l'eau, l'eau reste de l'eau et le sucre reste du sucre, qui se disperse
simplement dans l'eau (comme si on dispersait du sable noir dans du sable blanc).
Dans une réaction chimique, il y a changement de nature des corps : les réactifs deviennent des produits et il est
impossible de revenir en arrière. Il y a «disparition des réactifs et formation de produits, sans disparition d’atome
Combustion : Parmi toutes les réactions chimiques existantes, une "famille" se distingue : les réactions entre un
combustible et un comburant qui produisent de la chaleur s'appellent des combustions. Les combustions sont donc des
réactions chimiques, mais il existe des réactions chimiques qui ne sont pas des combustions (OUF!)
Exercice : Complétez le tableau en identifiant la nature des phénomènes suivants.
Formation de buée sur la vitre
Filtration d’une eau boueuse
Une bûche qui brûle dans une
cheminée
Le sucre « fond » dans le café
On fait une vinaigrette
Formation de givre sur l’herbe
Un moteur « transforme »
l’essence en gaz d’échappement
Gaz du briquet qui sort du
réservoir
Action d’un acide sur la craie
Gaz du briquet qui brûle
(il faudrait plutôt dire Le sucre « ………………………..» dans le café)
1
/
3
100%