Les Pressions Partielles et la Règle de Dalton pour la Plongée
Telechargé par
andry nantenaina rakotonirina

Formation Guide de Palanquée
–
CoDep
89
–
Saison 2010 /2011
LES PRESSIONS PARTIELLES
RÈGLE DE DALTON

LES PRESSIONS PARTIELLES
Introduction
Rappel
Mise en Evidence
–
Enoncé des Lois
Application à la Plongée
Plongée Nitrox
-
Trimix

INTRODUCTION
Il s’agit des lois régissant la répartition des
différents gaz dans les mélanges gazeux que
nous respirons.
L’étude de ces lois va nous permettre de
connaître le comportement des gaz contenus
dans l’air que nous respirons, et de mettre en
évidence les applications dans le domaine de la
plongée
.

RAPPEL
L’air n’est pas un corps simple mais un
mélange de différents gaz:
Composition
Taux en %
Azote
-
N2
-
78.084%
Oxygène
–
O2
–
20.946%
Argon
–
Ar
-
0.934%
Gaz Carbonique
–
CO2
-
0.033%
Les gaz dits «
rares
»
0.003%
Les gaz dits «
rares
» =
Néon (Ne) + Hélium (He) + Krypton (Kr) + Hydrogène (H2) + Xénon ‘Xe) + Radon ‘Rn) + Oxyde de
Carbone (CO)
Pour les calculs de plongée on considère = Azote 79% + Oxygène 21%

RAPPEL
L’azote est un gaz inerte. Il n’est pas métabolisé par
l’organisme
Il est sans couleur, sans odeur et sans goût
Et puis...
Le monoxyde de carbone est normalement absent de
l’air respiré
Il est issu de combustions incomplètes
Il est sans couleur, sans odeur et sans goût
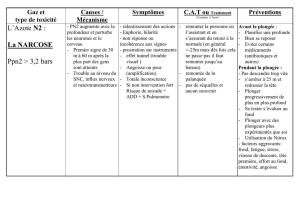
TOUS CES GAZ SONT TOXIQUES A UNE CERTAINE
PRESSION !
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%